题目内容
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
① CO2+ Na2CO3+ H2O === 2NaHCO3,CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
② 碳酸钠、碳酸氢钠在不同温度下的溶解度
0℃ | 10℃ | 20℃ | 30℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
① 配制碳酸钠溶液:取100 g 20℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
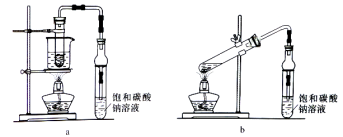
② 利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。

【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
① 取100 g 20℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 ② 利用装置二进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2 | 没有出现白色沉淀 |
(1)在0℃~30℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是 。
(2)大理石与稀盐酸反应的化学方程式为 。
(3)装置二中饱和碳酸氢钠溶液的作用是 。
【进行实验3】
实验操作 | 实验现象 |
① 取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20℃,取上层清液 ② 利用装置一和装置二分别进行实验,连续3分钟向新制得的碳酸钠溶液中通入CO2 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
(4)雯雯在最初的实验中没有看到沉淀现象的原因是 。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是 。
(6)请你依据题中信息,写出一种能够区分碳酸钠和碳酸氢钠固体的实验方案 。
【答案】(1)碳酸钠 (1分)
(2)CaCO3 + 2HCl=CaCl2 + H2O + CO2↑(3)排除HCl的干扰
(4)配制的碳酸钠溶液没有达到饱和
(5)碳酸氢钠溶解度小于碳酸钠,水减少,生成的碳酸氢钠的质量大于反应的碳酸钠
(6)方法一:取其中一种固体12 g,加入100 g热开水,充分溶解后,降温至20℃。若有固体析出,为碳酸氢钠;否则为碳酸钠
方法二:取其中一种固体12 g,加入100 g 20℃的水,充分溶解后,若有白色固体剩余,为碳酸氢钠;否则为碳酸钠
【解析】
试题分析:(1)在0℃~30℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是碳酸钠;
(2)大理石与稀盐酸反应的化学方程式为CaCO3 + 2HCl=CaCl2 + H2O + CO2↑;
(3)生成的CO2中混有氯化氢气体,因此装置二中饱和碳酸氢钠溶液的作用是吸收氯化氢气体,从而排除氯化氢气体对实验的干扰;
(4)雯雯在最初的实验中没有看到沉淀现象的原因是配制的碳酸钠溶液没有达到饱和;
(5)由于碳酸氢钠溶解度小于碳酸钠,随着反应的进行,水的质量减小,生成的碳酸氢钠的质量大于反应的碳酸钠,所以CO2通入饱和碳酸钠溶液会产生白色沉淀碳酸氢钠;
(6)根据表中物质的溶解度数据可知区分碳酸钠和碳酸氢钠固体的实验方案是:方法一:取其中一种固体12g,加入100g热开水,充分溶解后,降温至20℃。若有固体析出,为碳酸氢钠,否则为碳酸钠;
方法二:取其中一种固体12g,加入100g20℃的水,充分溶解后,若有白色固体剩余,为碳酸氢钠,否则为碳酸钠。