题目内容
为什么干燥的NaCl晶体不导电,而溶于水时却能导电呢?
答案:
解析:
解析:
|
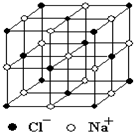
解析:在NaCl晶体里含有带正电的Na+和带负电的Cl-,由于静电的作用,它们按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的NaCl晶体不能导电. 当NaCl溶于水时,水分子的作用减弱了Na+和Cl-之间的静电作用,使NaCl晶体离解成能够自由移动的Na+和Cl-,因而NaCl溶液能够导电. 评注:离子化合物在熔化时能导电,溶于水时有的能导电(难溶物的水溶液不导电);属于电解质的共价化合物只在溶于水时才能导电. |

练习册系列答案
相关题目
下表是NaCl和CsCl的熔沸点的比较。
|
|
NaCl |
CsCl |
|
熔点 |
801 ℃ |
645 ℃ |
|
沸点 |
1 413 ℃ |
1 290 ℃ |
(1)同为离子晶体,为什么NaCl的熔沸点比CsCl的高?请从影响离子键强弱的因素入手进行分析。
(2)实验证明,干燥的NaCl晶体不导电,熔融的NaCl或NaCl溶液却可以导电,你能说明其中的原因吗?
 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下: g于体积为V1毫升的定容容器A中;② 用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
g于体积为V1毫升的定容容器A中;② 用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
 cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为:
cm。则利用上述方法测得的阿伏加德罗常数的数学表达式为: ______________________;
______________________;