��Ŀ����
����Ŀ������(N2H4)�ֳ�����������ʱ��һ�ֿ�ȼ��Һ�壬���������ȼ�ϡ�
(1)��֪��25�桢101kPaʱ��16g N2H4����������ȫȼ�����ɵ������ų�312kJ����������N2H4��ȫȼ�յ��Ȼ�ѧ����ʽ��__________________________________��
II������ͼ��ʾ��ij�о���ѧϰС����������ȼ��ԭ�����һ����(N2H4)������ȼ�ϵ��(��ͼ��)��̽��ijЩ��ҵԭ����������װ����XΪ�����ӽ���Ĥ(��ֻ����������ͨ��)��
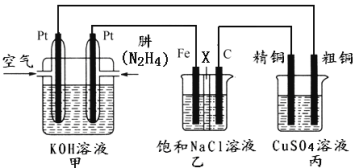
����Ҫ��ش�������⣺
(2)��װ����ͨ��________�����һ��Ϊ��������缫��ӦʽΪ��________________��
(3)��װ����ʯī�缫Ϊ_________������缫��ӦʽΪ_______________��������__________________����÷�Ӧ������һ��ʱ����ҳ��е���Һ��_______�ԡ�
(4)ͼ���ñ�װ��ģ�ҵ�е�_________________ԭ������������װ�þ�ͭ��������3.2g���������ϼ�װ��������������Ϊ___________g��
(5)��������еĴ�ͭ�缫��ΪPt�缫��������ܻ�ѧ����ʽΪ___________________________��
���𰸡�N2H4(l )+O2(g)=N2(g)+2H2O(l) ��H=-624kJ/mol ���� O2+4e-+2H2O=4OH- �� 2Cl--2e-=Cl2�� ʪ��ĵ⻯�ص�����ֽ �� ��ͭ�ľ��� 0.8 2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4
2Cu+O2��+2H2SO4
��������
(1)�����Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�Ͷ�Ӧ���ķ�Ӧ��д���Ȼ�ѧ����ʽ��
(2)�������������õ��ӷ�����ԭ��Ӧ��
(3)��װ����ʯī�缫���Դ�������ӣ�Ϊ�������������������ӷŵ��������������������ķ�������ʪ��ĵ��۵⻯����ֽ���۲��Ƿ���������ݵ���ܷ�Ӧ����ʽ���ж���Һ������ԣ�
(4)����ͬһ�պϻ�·��ת�Ƶ�����ȣ��г���ϵʽ��N2H4��2Cu���з�����⣻
(5)Pt�缫Ϊ���Ե缫���ö��Ե缫���CuSO4��Һ���������ӷŵ���Ⱥ�˳��ȷ����Һ���ܷ�Ӧ����ʽ��
(1)16.0g��̬��(N2H4)���ʵ���Ϊn(N2H4)=16g��32g/mol=0.5mol������������ȫȼ�����ɵ�����ˮ���ų�����312kJ��1mol��̬��(N2H4)ȼ�շ���624kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2H4(l )+O2(g)=N2(g)+2H2O(l) ��H=-624kJ/mol��
(2)��װ����ͨ������ĵ缫Ϊ�����������Ͽ����е������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O=4OH-��
(3)����װ��ͼ��֪����װ����ʯī�缫���Ӽ�װ�õ������������������������������ӷŵ������������缫��ӦʽΪ��2Cl--2e-=Cl2�������������ķ�������ʪ��ĵ��۵⻯����ֽ�����۲쵽ʪ��ĵ��۵⻯����ֽ��������֤������������������Ϊ���Ե缫����ⱥ��ʳ��ˮ���ܷ�Ӧ����ʽΪ��2NaCl+2H2O![]() Cl2��+H2��+2NaOH���ɼ����һ��ʱ����ҳ��е���Һ�ʼ��ԣ�
Cl2��+H2��+2NaOH���ɼ����һ��ʱ����ҳ��е���Һ�ʼ��ԣ�
(4)��װ���д�ͭ���ӵ�Դ������������������ͭ���ӵ�Դ�ĸ������������������Ϊ����ͭ��Һ�����ͼ���ñ�װ��ģ�ҵ�е�ͭ�ľ���ԭ����������ͬһ�պϻ�·�е���ת����Ŀ��ȣ����Ը��ݹ�ϵʽ��N2H4��2Cu��n(Cu)=3.2g��64g/mol=0.05mol������n(N2H4)=![]() n(Cu)=
n(Cu)=![]() ��0.05mol=0.025mol����m(N2H4)= 0.025mol��32g/mol=0.8g��
��0.05mol=0.025mol����m(N2H4)= 0.025mol��32g/mol=0.8g��
(5)��������еĴ�ͭ�缫��ΪPt�缫������Pt�缫Ϊ���Ե缫���������������Һ�е�OH-ʧȥ���ӣ���ΪO2�������ϣ���Һ�е�Cu2+��õ��ӱ�ΪCu���ʣ����Ա����ܻ�ѧ����ʽΪ2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��
2Cu+O2��+2H2SO4��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ�������´��ڷ�Ӧ��C(s)+H2O(g)![]() CO(g)+H2(g)��H>0����ס��ҡ����������������м���һ�����ij�ʼ���ʣ����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������CO�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
CO(g)+H2(g)��H>0����ס��ҡ����������������м���һ�����ij�ʼ���ʣ����������¶ȡ���Ӧ�����ʼ�����±�����Ӧ������CO�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
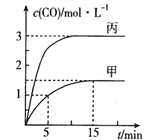
���� | �� | �� | �� |
�ݻ�(L) | 0.5 | 0.5 | V |
�¶�(��) | T1 | T2 | T1 |
��ʼ�� | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
����˵����ȷ����
A. ������������Ӧ��5��15mim���ƽ������v(CO)=0.15mol��L-1��min-1
B. �¶�ΪT1��ʱ����Ӧ��ƽ�ⳣ��K=9
C. ������������ƽ��ʱn(C)=0.2mol����T2<T1
D. �����������V=0.4



