题目内容
11.下列依据热化学方程式得出的结论错误的是( )| A. | 已知HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40gNaOH的稀溶液与足量稀醋酸完全中和放出的热量小于57.3kJ | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,此反应的△H变为-46.2kJ•mol-1 | |
| C. | 已知2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ•mol-1,则氢气燃烧热为285.8kJ/mol | |
| D. | 已知S(s)+O2(g)═SO2(g)△H1,S(g)+O2(g)═SO2(g)△H2,则△H1>△H2 |
分析 A.n(NaOH)=$\frac{40g}{40g/mol}$=1mol,与醋酸反应生成1molH2O(l),但醋酸电离吸热;
B.由N元素的化合价变化可知,转移6mol电子放热为92.4kJ,但反应的焓变与转化电子多少无关;
C.1molH2完全燃烧生成液态水放热的热量为燃烧热,且物质的量与热量成正比,互为逆反应时焓变数值相同、符号相反;
D.生成物相同,反应物中气态S比固体S的能量高,均为放热反应,焓变为负.
解答 解:A.n(NaOH)=$\frac{40g}{40g/mol}$=1mol,与醋酸反应生成1molH2O(l),但醋酸电离吸热,则含40gNaOH的稀溶液与足量稀醋酸完全中和放出的热量小于57.3kJ,故A正确;
B.由N元素的化合价变化可知,转移6mol电子放热为92.4kJ,但反应的焓变与转化电子多少无关,则当有3NA个电子转移时,放热为46.2kJ,但△H不变,故B错误;
C.1molH2完全燃烧生成液态水放热的热量为燃烧热,且物质的量与热量成正比,互为逆反应时焓变数值相同、符号相反,则由2H2O(l)═2H2(g)+O2(g)△H=+571.6kJ•mol-1,可知氢气燃烧热为285.8kJ/mol,故C正确;
D.生成物相同,反应物中气态S比固体S的能量高,均为放热反应,焓变为负,则S(g)+O2(g)═SO2(g)放热多,对应焓变小,即△H1>△H2,故D正确;
故选B.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、中和热、燃烧热及焓变为解答的关键,侧重分析与应用能力的考查,注意焓变与反应有关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列溶液中,跟100mL 1mol/L NaCl溶液所含的Cl-数目相同的是( )
| A. | 25mL 0.5mol/L HCl溶液 | B. | 200mL 0.5mol/L KCl溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 100mL 0.5mol/L MgCl2溶液 |
2.下列说法正确的是( )
| A. | 32gO2占有的体积为 22.4L | |
| B. | 22.4LN2 含有阿伏加德罗常数个 N2 | |
| C. | 在标准状况下,22.4L 水的物质的量为 1mol | |
| D. | 22gCO2 和 16gO2,在同温、同压下占有的体积相同 |
6.乙苯催化脱氢制苯乙烯反应: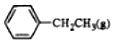 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$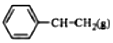 +H2O,己知:
+H2O,己知:
根据表中数据计算上述反应的△H(kJ•mol-1)( )
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
16.有机物的结构可用“键线式”表示,下列有关键线式为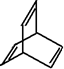 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )
 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为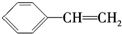 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
7.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
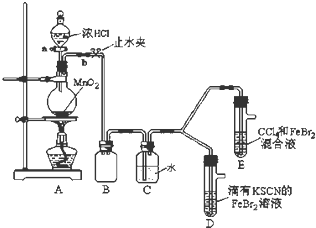
(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.

(1)①装置A中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液(或FeCl3溶液)溶液,若溶液颜色变红色(或不变红),则上述解释是合理的.
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.
4.下列说法中正确的是( )
| A. | 同温同压下,气体的物质的量与体积成反比 | |
| B. | 同温同体积时,气体的物质的量与压强成反比 | |
| C. | 同温同物质的量时,气体的压强与体积成正比 | |
| D. | 同压同体积时,气体的物质的量与温度成反比 |
5.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
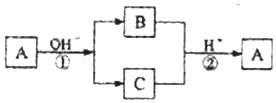

| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |