题目内容
4.在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
(蓝) (绿)
能使黄绿色CuCl2溶液向蓝色转化的操作是( )
| A. | 蒸发浓缩 | B. | 加水稀释 | C. | 加入AgNO3 | D. | 加入食盐晶体 |
分析 使黄绿色CuCl2溶液向蓝色转化,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动.
A、溶液中存在平衡Cu2++2H2O?Cu(OH)2+2HCl,蒸发浓缩HCl挥发,产生氢氧化铜沉淀;
B、加水稀释,溶液中离子浓度降低,平衡向生成:[Cu(H2O)4]2+方向移动;
C、加入AgNO3,消耗溶液中的氯离子,则溶液中Cl-浓度浓度减小;
D、加入食盐晶体,溶液中Cl-浓度浓度增大.
解答 解:使黄绿色CuCl2溶液向蓝色转化,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动.
A、溶液中存在平衡Cu2++2H2O?Cu(OH)2+2HCl,蒸发浓缩HCl挥发,产生氢氧化铜沉淀,故A错误;
B、加水稀释,溶液中离子浓度降低,平衡向生成[Cu(H2O)4]2+方向移动,故B正确;
C、加入AgNO3,消耗溶液中的氯离子,则溶液中Cl-浓度浓度减小,平衡向逆移动,故C正确;
D、加入食盐晶体,溶液中Cl-浓度浓度增大,平衡向向右移动,故D错误.
故选BC.
点评 本题考查平衡的移动,难度中等,可以借助平衡常数理解稀释对平衡的影响.

练习册系列答案
相关题目
14.能在水溶液中大量共存的一组离子是( )
| A. | Ba2+、K+、OH-、SO42- | B. | Fe3+、NO3-、Na+、OH- | ||
| C. | H+、Na+、Cl-、SO42- | D. | K+、SO42-、HCO3-、H+ |
19.标准状况下,与16gO2所占体积大致相等的是( )
| A. | 0.5molH2O | B. | 5.6L甲烷 | C. | 3.01×1023个N2 | D. | 44gCO2 |
9.某烷烃的结构简式为: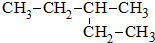 其系统命名正确的是( )
其系统命名正确的是( )
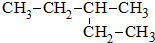 其系统命名正确的是( )
其系统命名正确的是( )| A. | 2-乙基丁烷 | B. | 3-乙基丁烷 | C. | 3-甲基丁烷 | D. | 3-甲基戊烷 |
16.在无色透明溶液中,能大量共存的离子组是( )
| A. | K+ Cu2+ Na+ SO42- | B. | Mg2+ Cl- OH- SO42- | ||
| C. | K+ H+ NO3- CO32- | D. | Na+ Cl- NO3-CO32- |
13.下列有关铁、铝及其合金的说法正确的是( )
| A. | 铁、铝的都属于轻金属 | |
| B. | 生铁的硬度和熔点都比纯铁高 | |
| C. | 铁、铝的单质都具有银白色金属光泽,都属于有色金属 | |
| D. | 金属形成合金后通常具有更多优良性能,所以用途更广泛 |
13.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(1)△H1=-Q1 KJ/mol
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
2H2(g)+O2(g)═2H2O(g)△H2=-Q2 KJ/mol
2H2(g)+O2(g)═2H2O(1)△H3=-Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | △H2>△H3 | D. | △H2<△H3 |
 在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图:
在一密闭体系中发生下列反应:N2+3H2?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图: