题目内容
卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
| A、卤素单质的最外层电子数都是7 |
| B、从上到下,卤素原子的电子层数依次增多,半径依次减小 |
| C、从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱 |
| D、卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:A、同主族元素的原子最外层电子数相同;
B、电子层数越大,原子半径越大;
C、同主族元素从上到下,得电子能力减弱;
D、非金属性越强,则单质与氢气化合越容易.
B、电子层数越大,原子半径越大;
C、同主族元素从上到下,得电子能力减弱;
D、非金属性越强,则单质与氢气化合越容易.
解答:
解:A、同主族元素的原子最外层电子数相同,卤素原子的最外层7个电子,但是卤素单质的最外层电子数都是8,故A错误;
B、电子层数越大,原子半径越大,从上到下,卤素原子的电子层数依次增多,半径依次增大,故B错误;
C、同主族元素从上到下,得电子能力减弱,则从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故C正确;
D、非金属性越强,则单质与氢气化合越容易,非金属性:F>Cl>Br>I,则卤素单质与H2化合的容易程度为F2>Cl2>Br2>I2,故D错误.
故选C.
B、电子层数越大,原子半径越大,从上到下,卤素原子的电子层数依次增多,半径依次增大,故B错误;
C、同主族元素从上到下,得电子能力减弱,则从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故C正确;
D、非金属性越强,则单质与氢气化合越容易,非金属性:F>Cl>Br>I,则卤素单质与H2化合的容易程度为F2>Cl2>Br2>I2,故D错误.
故选C.
点评:本题考查同主族元素对应单质的性质的递变规律,题目难度不大,注意元素周期律的递变规律,注意把握卤素原子的结构及其性质.

练习册系列答案
相关题目
将苯与溴水混合,充分振荡后静置,用分液漏斗分离出上层液体放置于一试管中,若向其中加入一种试剂,可发生反应并产生白雾,这种试剂可以是( )
| A、亚硫酸钠 | B、溴化铁 |
| C、锌粉 | D、铁粉 |
下列烃及烃的高聚物:①乙烷;②苯;③聚丙烯;④聚-2-甲基-1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧石油裂解气,能使酸性KMnO4溶液褪色,也能与溴水反应而使溴水褪色的是( )
| A、②③④⑤⑥⑦⑧ | B、③④⑤⑥⑦⑧ |
| C、④⑤⑧ | D、④⑤⑦ |
mg铜和足量硝酸溶液反应,生成VL气体(标准状况),则反应中发生转移的电子的物质的量最接近于( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关四种治疗禽流感药物的说法不正确的是( )
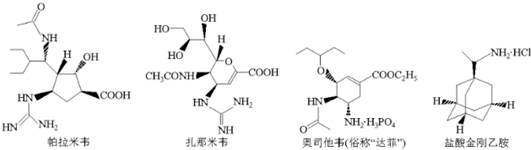

| A、帕拉米韦的分子式为C15H27N4O4 |
| B、扎那米韦与帕拉米韦的钠盐可用新制Cu(OH)2悬浊液鉴别 |
| C、1mol达菲最多能与5molNaOH反应 |
| D、盐酸金刚乙胺六元环上的一个氢原子被氯原子取代,所得一氯代物有三种 |
将4.6g金属钠分别投入100g下列不同的溶液中:①10%HCl溶液;②10%NaOH溶液; ③2%CuSO4溶液所放出的氢气质量关系正确的是( )
| A、①>②>③ |
| B、①>③>② |
| C、②>①>③ |
| D、①=②=③ |
下列说法中不正确的是( )
| A、已知原子的核电荷数,可以推知该原子的周期序数 |
| B、原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数 |
| C、知道原子的周期序数,就能确定该元素在周期表中的位置 |
| D、知道原子的周期序数,还不能确定该元素在周期表中的位置 |

