��Ŀ����
����Ŀ��(1)ʯ�ͺ�ú����Ҫ����Դ���ʣ�����˵���������___��
a��ʯ�ͺ�ú�Dz���������Դ
b��úΪ�������б����ױ������ױ����л���
c��ú�ĸ����ʯ�͵ķ����������仯
d��úȼ�ռ�����β������ɿ�����Ⱦ����Ҫԭ��
e����ú��ʯ��Ϊԭ�Ͽ��������ϡ��ϳ����ϳ���ά�Ⱥϳɲ���
(2)��úΪԭ�Ͼ���һϵ�з�Ӧ������������������ϳ�·�����£�
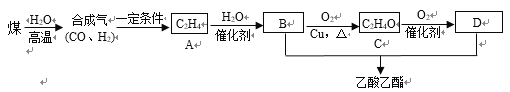
��C��������______��A��B�ķ�Ӧ������_______��
�ھ���������B���ʵĻ���������_________��
��B��C�Ļ�ѧ����ʽΪ_______________________________��
B+D�����������Ļ�ѧ����ʽΪ________________________________��
(3)ij��ѧʵ��С���ͬѧ��������ͼװ����ȡ����������

������B��������_______������A����ȴˮ�Ľ�����_____(����a������b��)��
�ڹ۲�����A���ڲ�ṹ���볤ֱ������Ƚϣ��÷�Ӧװ�õ��ŵ���_______��
�۽��Ҵ������ᰴ�����ʵ���3��2��ϵõ�258g���Һ����Ũ���������·�����Ӧ�����������IJ���Ϊ50%�������ɵ�����������������_______g��(��Է����������Ҵ���46��������60������������88)
���𰸡�bc ��ȩ �ӳɷ�Ӧ �ǻ� 2C2H5OH+O2 ![]() 2CH3CHO + 2H2O CH3COOH + C2H5OH
2CH3CHO + 2H2O CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O ֱ�������ܻ������� a ����Ӵ����������Ч������ 88
CH3COOC2H5 + H2O ֱ�������ܻ������� a ����Ӵ����������Ч������ 88
��������
(1) a��ʯ�ͺ�ú�ǻ�ʯȼ�ϣ�
b��úΪ����ú�ĸ�������к��б����ױ������ױ����л��
c��ú�ĸ���ָú�ڸ������������¼��ȡ��ֽ⣬���ɽ�̿(��뽹)��ú���͡��ֱ���ú���Ȳ���Ĺ��̣�ú�ĸ��������ڻ�ѧ�仯��ʯ�͵ķ����ǽ�ʯ�ͷ��뼸�ֲ�ͬ�е�Ļ�����һ�ַ��������������仯��
d��úȼ�ղ���������������β���к��е������
e�����ϡ��ϳ����ϳ���ά���Ի�ʯȼ��Ϊԭ�Ͼ����ۺϷ�Ӧ�õ��IJ�Ʒ��
(2)ú�ڸ�������ˮ��Ӧ���ɺϳ���(һ����̼������)���ϳ�����һ�������·�Ӧ����A(��ϩ)����ϩ�ڴ�����������ˮ�����ӳ������Ҵ�����BΪ�Ҵ����Ҵ���ͭ����������������������������������Ӧ������ȩ����CΪ��ȩ����ȩ�ڴ�����������������Ӧ��������Ϊ���ᣬDΪ���ᣬB(�Ҵ�)��D(����)����������Ӧ���������������ݴ˷������
(3) �ٸ�����������������ƣ���ȴˮ�½��ϳ���
������A���ڲ�ṹ���볤ֱ������Ƚϣ������������Ӵ������
�۸��ݷ�Ӧ�ͱ�����ϵ���ƶ��Ҵ����������㷴Ӧ��������������ݷ�Ӧ����ʽ���������������������ݲ���=![]() ��������������ʵ�ʲ�����
��������������ʵ�ʲ�����
(1) a��ʯ�ͺ�ú�ǻ�ʯȼ�ϣ���ʯȼ�ϲ�����������a��ȷ��
b��ú����Ҫ�ɷ�Ϊ̼���⡢���������ĵ����������Ԫ�صĸ��ӻ���ú�ĸ�������к��б����ױ������ױ����л����b����
c��ú�ĸ���ָú�ڸ������������¼��ȡ��ֽ⣬���ɽ�̿(��뽹)��ú���͡��ֱ���ú���Ȳ���Ĺ��̣�ú�ĸ��������ڻ�ѧ�仯��ʯ�͵ķ����ǽ�ʯ�ͷ��뼸�ֲ�ͬ�е�Ļ�����һ�ַ��������������仯����c����
d��ú�к�����ȼ�ղ���������������β���к��е���������ɵ������Ϊ������Ⱦ���d��ȷ��
e�����ϡ��ϳ����ϳ���ά���Ի�ʯȼ��Ϊԭ�Ͼ����ۺϷ�Ӧ�õ��IJ�Ʒ����e��ȷ��
��ѡbc��
(2)�ٸ��ݷ�����C����������ȩ��A��B�ķ�Ӧ�����Ǽӳɷ�Ӧ��
��BΪ�Ҵ�������������B���ʵĻ����������ǻ���
��B��CΪ�Ҵ���ͭ����������������������������������Ӧ������ȩ����ѧ����ʽΪ2C2H5OH+O2![]() 2CH3CHO+2H2O��B+D�����������Ļ�ѧ����ʽΪCH3COOH + C2H5OH
2CH3CHO+2H2O��B+D�����������Ļ�ѧ����ʽΪCH3COOH + C2H5OH![]() CH3COOC2H5 + H2O��
CH3COOC2H5 + H2O��
(3)�ٸ���������������B��������ֱ�������ܻ������ܣ�װ��A����ȴˮ�½��ϳ������ˮ��Ϊa��
������A���ڲ�ṹ���볤ֱ������Ƚϣ������������Ӵ����������������Ч�����ã�
�����Ҵ������ʵ���Ϊ3xmol������������ʵ���Ϊ2xmol�����ݷ�ӦCH3COOH + C2H5OH![]() CH3COOC2H5 + H2O���Ҵ���������46��3x+60��2x=258�����x=1�����뷴Ӧ����������ʵ���Ϊ2mol���������������������������ʵ���Ϊ2mol�����ݲ���=
CH3COOC2H5 + H2O���Ҵ���������46��3x+60��2x=258�����x=1�����뷴Ӧ����������ʵ���Ϊ2mol���������������������������ʵ���Ϊ2mol�����ݲ���=![]() �������ɵ�����������ʵ������=2mol��88��50%=88g��
�������ɵ�����������ʵ������=2mol��88��50%=88g��

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�����Ŀ���й���ͳ�Ļ��������������Ŵ������м����˺ܶѧ�о��ɹ������г�����ʫ�Ķ�Ӧ��ѧ֪ʶ��ȷ����![]()
ѡ�� | ��ʫ�� | ��ѧ֪ʶ |
A |
| ����������ˮ������Ϊˮ�������ȷ�Ӧ |
B |
| ��ǿˮ����ָ����� |
C |
| ����Ϊ���ĺϽ���Ӳ�ȱȴ����Ĵ��۵�ȴ����ĸ� |
D |
| ������ʯ��������������ɫ��Ӧ |
A.AB.BC.CD.D
����Ŀ��ij�о���ѧϰС�����ʵ��̽��Ԫ�������ɺͻ�ѧ��Ӧ���ʡ�
(1)����ͬѧ������ͼװ��̽��ͬ���ں�ͬ����Ԫ�طǽ����Ե�ǿ����
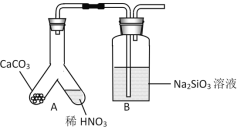
��A�з�Ӧ����Ϊ____����֤̼�ķǽ����Աȵ���___(����ǿ����������)��
��B�з�Ӧ����Ϊ____����֤̼�ķǽ����Աȹ��___(����ǿ����������)��
�۽��ۣ�ͬһ���ڴ�����Ԫ�طǽ�������____(������ǿ������������)�� ͬһ������ϵ���Ԫ�طǽ�������_______(������ǿ������������)��
��ijͬѧ���ǵ�ϡ����Ļӷ�����װ��A��B֮������һ��ʢ��_______�Լ���ϴ��ƿ��
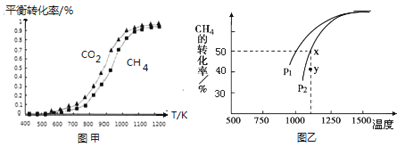
(2)����ͬѧ�ں��������н���������ʵ�飬��ӦΪ��2HI(g)H2(g)+I2(g)��H2��I2����ʼŨ�Ⱦ�Ϊ0����Ӧ��HI��Ũ���淴Ӧʱ��ı仯������±���
ʵ����� | ʱ��/min Ũ��/molL��1 �¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 400 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
2 | 400 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 450 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
��ʵ��1�У���10��20 min�ڣ�v(HI)=__________molL��1min��l��
��0��20 min�ڣ�ʵ��2��ʵ��1�ķ�Ӧ����______(����������������)����ԭ�������_______________��
��ʵ��3��ʵ��2�ķ�Ӧ�ﵽƽ��ʱ��_________(����������������)����ԭ����_________________________________________��