题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置 ;
②C单质分子的电子式 ;
③用电子式表示A和B元素组成的化合物的形成过程: .
(2)元素D与元素A相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
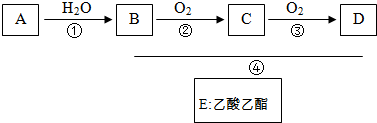
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为(其他条件略去).X
Y
Z
W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为: ;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为 .
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置
②C单质分子的电子式
③用电子式表示A和B元素组成的化合物的形成过程:
(2)元素D与元素A相比,非金属性较强的是
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为(其他条件略去).X
| o2 |
| o2 |
| H2o |
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A有三个电子层,K、M层电子数之和等于L层电子数,故A为硫;B短周期中金属性最强,故B为钠;C常温下单质为双原子分子,氢化物的水溶液呈碱性,故C为氮;D元素最高正价是+7价,故为氯,据此解答各小题即可.
解答:
解:依据分析可知:A为硫,B为钠,C为氮,D为氯,
(1)①A为硫,处于第三周期第VIA族,故答案为:第三周期第VIA族;
②C为氮,其单质为N与N形成三对共价键,故N2电子式为: ,故答案为:
,故答案为: ;
;
③Na与S形成化合物:Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为: 故答案为:
故答案为: ;
;
(2)元素D为Cl,元素A为S,同一周期中,原子序数越大,非金属性越强,故非金属性Cl>S,
a.常温下D的单质和A的单质状态不同,非金属性与物理性质无关,故a错误;
b.D的氢化物比A的氢化物稳定,气态氢化物越稳定,非金属性越强,故b正确;
c.一定条件下D和A的单质都能与钠反应,不能证明非金属性强弱,故c错误;
d.A最高价含氧酸的酸性弱于D最高价含氧酸,说明D的非金属性强,故的正确;
e.D单质能与A的氢化物反应生成A单质,活泼非金属置换不活泼非金属,故e正确,故选:b、d、e,故答案为Cl;bde;
(3)①结合图示中的转化关系知:有刺激性气味的无色气体为二氧化硫,二氧化硫具有还原性,双氧水具有氧化性,故发生反应:BaCl2+SO2+H2O2═BaSO4↓+2HCl,故答案为:BaCl2+SO2+H2O2═BaSO4↓+2HCl;
②Z是红棕色气体,结合图示中转化关系得知Z为二氧化氮,二氧化氮溶于水发生反应:3NO2+2H2O═2HNO3+NO,NO2既是氧化剂又是还原剂,其中3molNO2中的2mol氮元素被氧化生成硝酸,此部分为还原剂,故氧化剂为1mol,故答案为:1:2.
(1)①A为硫,处于第三周期第VIA族,故答案为:第三周期第VIA族;
②C为氮,其单质为N与N形成三对共价键,故N2电子式为:
 ,故答案为:
,故答案为: ;
; ③Na与S形成化合物:Na2S,硫化钠为离子化合物,用电子式表示Na2S的形成过程为:
 故答案为:
故答案为: ;
;(2)元素D为Cl,元素A为S,同一周期中,原子序数越大,非金属性越强,故非金属性Cl>S,
a.常温下D的单质和A的单质状态不同,非金属性与物理性质无关,故a错误;
b.D的氢化物比A的氢化物稳定,气态氢化物越稳定,非金属性越强,故b正确;
c.一定条件下D和A的单质都能与钠反应,不能证明非金属性强弱,故c错误;
d.A最高价含氧酸的酸性弱于D最高价含氧酸,说明D的非金属性强,故的正确;
e.D单质能与A的氢化物反应生成A单质,活泼非金属置换不活泼非金属,故e正确,故选:b、d、e,故答案为Cl;bde;
(3)①结合图示中的转化关系知:有刺激性气味的无色气体为二氧化硫,二氧化硫具有还原性,双氧水具有氧化性,故发生反应:BaCl2+SO2+H2O2═BaSO4↓+2HCl,故答案为:BaCl2+SO2+H2O2═BaSO4↓+2HCl;
②Z是红棕色气体,结合图示中转化关系得知Z为二氧化氮,二氧化氮溶于水发生反应:3NO2+2H2O═2HNO3+NO,NO2既是氧化剂又是还原剂,其中3molNO2中的2mol氮元素被氧化生成硝酸,此部分为还原剂,故氧化剂为1mol,故答案为:1:2.
点评:本题考查了电子式、用电子式表示离子化合物的形成过程,题目难度中等,注意掌握电子式的表示方法,能够用电子式表示离子化合物的形成过程.

练习册系列答案
相关题目
在氧化还原反应中,氧化性强的物质能首先发生还原反应.已知氧化性Fe3+>Cu2+,现向含有0.1mol Fe2(SO4)3和0.2molCuCl2的某混合溶液中加入0.2molFe,充分反应后下列说法正确的是( )
| A、析出0.2molCu |
| B、剩余0.1molFe |
| C、没有金属析出 |
| D、剩余0.1mol的Cu2+ |
“绿色商品”是对环境无污染的商品,下列商品不能称为“绿色商品”的是( )
| A、无铅汽油 | B、无磷洗涤剂 |
| C、无氟冰箱 | D、无碘食盐 |
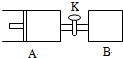 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
| A、白色沉淀不含BaSO3 |
| B、溶液的酸性减弱 |
| C、白色沉淀是BaSO4 |
| D、FeCl3全部被还原为FeCl2 |