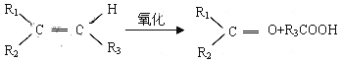
题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
③HClO2可看成是强酸。
(1)160 g·L-1NaOH溶液的物质的量浓度为__________________,若要计算该溶液溶质的质量分数,还需要的一个条件是____。
(2)在发生器中鼓入空气的作用可能是____(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为____;
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:_________________。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是___________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是__________________ (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____(填操作名称)。
【答案】4 mol/L 该溶液的密度 B 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 2H2O2![]() 2H2O+O2↑ 连续测定吸收塔内溶液的pH A、D B、E、D或E、D 重结晶
2H2O+O2↑ 连续测定吸收塔内溶液的pH A、D B、E、D或E、D 重结晶
【解析】
NaClO3溶液与稀硫酸在ClO2发生器中发生反应产生ClO2,ClO2在二氧化硫和空气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO23H2O。
(1)浓度g/L表示1 L溶液中所含溶质质量的多少,160 g/LNaOH溶液表示1 L氢氧化钠溶液含有160 gNaOH,假设溶液体积为1 L,则160 gNaOH的物质的量n(NaOH)= ![]() =4 mol,所以该溶液氢氧化钠的物质的量浓度c(NaOH)=
=4 mol,所以该溶液氢氧化钠的物质的量浓度c(NaOH)=![]() =4 mol/L,若要计算该溶液的质量分数,必须知道溶液的质量,据m(溶液)=ρ·V可知,还要知道溶液的密度;
=4 mol/L,若要计算该溶液的质量分数,必须知道溶液的质量,据m(溶液)=ρ·V可知,还要知道溶液的密度;
(2)由信息②可知,纯ClO2易分解爆炸,发生器中鼓入空气的作用应是稀释ClO2,以防止爆炸,故合理选项是B;
(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,H2O2分解的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)NaClO2在溶液pH>11.5时的碱性溶液中比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是连续测定吸收塔内溶液的pH;
(5)吸收塔中还原性要适中,还原性太强,会将ClO2还原为更低价态产物,影响NaClO2生产;方便后续分离提纯,加入试剂不能干扰后续生产,Na2O2溶于水相当于H2O2,Na2S、FeCl2还原性较强,生成物与NaClO2分离比较困难,PbO悬浊液与水反应产生Pb2+和水,Pb2+还原性较弱,可以加入,故合理选项是AD;
(6)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,故分离混合物的方法是B、E、D或E、D;
然后再通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体,要得到更纯的NaClO2·3H2O晶体必须进行的操作是重结晶。

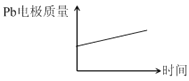
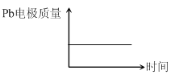
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D