题目内容
(1)写出以石墨为电极,H2、O2、Na2SO4溶液构成的燃料电池的电极反应式:负极:______;正极:______
(2)写出以石墨为电极,H2、O2、H2SO4溶液构成的燃料电池的电极反应式:负极:______;正极:______
(3)写出以石墨为电极,H2、O2、NaOH溶液构成的燃料电池的电极反应式:负极:______;正极:______.
(2)写出以石墨为电极,H2、O2、H2SO4溶液构成的燃料电池的电极反应式:负极:______;正极:______
(3)写出以石墨为电极,H2、O2、NaOH溶液构成的燃料电池的电极反应式:负极:______;正极:______.
(1)氢氧燃料电池的电解质是硫酸钠时,电池总反应式均可表示为:2H2+O2=2H2O,其负极反应为:2H2-4e-=4H+,正极反应为:O2+4e-+2H2O=4OH-,故答案为:2H2-4e-=4H+;O2+4e-+2H2O=4OH-;
(2)氢氧燃料电池的电解质是酸时,电池总反应式均可表示为:2H2+O2=2H2O①,其负极反应为:2H2-4e-=4H+②,则正极反应为 ①-②,即O2+4e-+4H+=2H2O,故答案为:2H2-4e-=4H+;O2+4e-+4H+=2H2O;
(3)氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O①,其正极反应表示为:O2+2H2O+4e-=4OH-③,则负极反应为①-③,即2H2-4e-+4OH-=4H2O,故答案为:2H2-4e-+4OH-=4H2O; O2+4e-+2H2O=4OH-;
(2)氢氧燃料电池的电解质是酸时,电池总反应式均可表示为:2H2+O2=2H2O①,其负极反应为:2H2-4e-=4H+②,则正极反应为 ①-②,即O2+4e-+4H+=2H2O,故答案为:2H2-4e-=4H+;O2+4e-+4H+=2H2O;
(3)氢氧燃料电池的电解质是碱时,电池总反应式均可表示为:2H2+O2=2H2O①,其正极反应表示为:O2+2H2O+4e-=4OH-③,则负极反应为①-③,即2H2-4e-+4OH-=4H2O,故答案为:2H2-4e-+4OH-=4H2O; O2+4e-+2H2O=4OH-;

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目


 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是



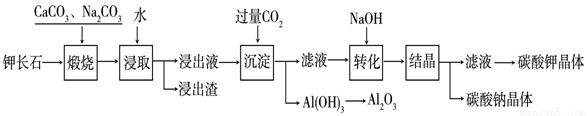
 Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。
Al(OH)3
+ OH— ,“浸取”时应保持溶液呈
性(填“酸”或“碱”)。