题目内容
水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)

CO (g)+H2 (g);△H=+131.3kJ?mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍.平衡时水蒸气的转化率为______;向该容器中补充 a mol 炭,水蒸气的转化率将______(填“增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O),最终容器中C16O和C18O 的物质的量之比为______.
(3)己知:C (s)+1/2O2(g)=CO (g);△H=-110.5kJ?mo1-1CO(g)+1/2O2(g)=CO2 (g);△H=-283.0kJ?mo1-1
H2 (g)+1/2O2(g)=H2O (g);△H=-241.8kJ?mo1-1那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=______kJ?mo1-1.

CO (g)+H2 (g);△H=+131.3kJ?mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | V正、V逆比较 |
| I | 0.06 | 0.60 | 0.10 | V正=V逆 |
| II | 0.06 | 0.50 | 0.40 | ? |
| III | 0.12 | 0.40 | 0.80 | V正<V逆 |
| IV | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+1/2O2(g)=CO (g);△H=-110.5kJ?mo1-1CO(g)+1/2O2(g)=CO2 (g);△H=-283.0kJ?mo1-1
H2 (g)+1/2O2(g)=H2O (g);△H=-241.8kJ?mo1-1那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=______kJ?mo1-1.
(1)由反应Ⅰ达到平衡状态可知,反应的平衡常数K=
=1,
反应Ⅱ中Qc=
=3.33>1,则反应向逆反应方向移动,即V正<V逆,
反应Ⅳ中V正=V逆,说明反应达平衡状态,则有
=1,c(H2)=0.4mol/L,
故答案为:
(2)根据反应方程式利用三段式法计算,转化的水蒸汽为x,根据体积之比等于物质的量之比计算,
C (s)+H216O(g)

C16O (g)+H2 (g)
起始:1mol 0 0
转化:x x x
平衡:1-x x x
则有:
=1.25,x=0.25mol,所以转化率为
× 100%=25%,
增加固体的对反应速率和化学平衡都没有影响,水蒸气的转化率不变,
恒温恒压下,再补充 a mol 水蒸气 (H218O),平衡状态不变,为等效平衡,水的转化率相等,则有生成的C18O 的物质的量为a×25%=0.25a,
所以达平衡时C16O和C18O 的物质的量之比为0.25:0.25a=1:a,
故答案为:25%;不变;1:a;
(3)n(C)=
=0.2mol,与水反应生成0.2molCO和0.2molH2,反应吸收的热量为0.2mol×131.3KJ/mol=26.26KJ,
0.2molCO完全燃烧放出的热量为0.2mol×283KJ/mol=56.6KJ,
0.2molH2完全燃烧放出的热量为0.2mol×241.8KJ/mol=48.36KJ,
所以将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程放出的热量为56.6KJ+48.36KJ-26.26KJ=78.7KJ,
整个过程△H=-78.7kJ?mo1-1,故答案为:-78.7.
| 0.1×0.60 |
| 0.06 |
反应Ⅱ中Qc=
| 0.4×0.5 |
| 0.06 |
反应Ⅳ中V正=V逆,说明反应达平衡状态,则有
| 0.3×c(H2) |
| 0.12 |
故答案为:
| V正<V逆 | ||||
| 0.40 |
C (s)+H216O(g)

C16O (g)+H2 (g)
起始:1mol 0 0
转化:x x x
平衡:1-x x x
则有:
| (1-x)+x+x |
| 1 |
| 0.25 |
| 1 |
增加固体的对反应速率和化学平衡都没有影响,水蒸气的转化率不变,
恒温恒压下,再补充 a mol 水蒸气 (H218O),平衡状态不变,为等效平衡,水的转化率相等,则有生成的C18O 的物质的量为a×25%=0.25a,
所以达平衡时C16O和C18O 的物质的量之比为0.25:0.25a=1:a,
故答案为:25%;不变;1:a;
(3)n(C)=
| 2.4g |
| 12g/mol |
0.2molCO完全燃烧放出的热量为0.2mol×283KJ/mol=56.6KJ,
0.2molH2完全燃烧放出的热量为0.2mol×241.8KJ/mol=48.36KJ,
所以将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程放出的热量为56.6KJ+48.36KJ-26.26KJ=78.7KJ,
整个过程△H=-78.7kJ?mo1-1,故答案为:-78.7.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,他们之间有如下转化关系: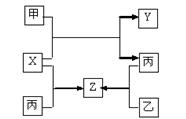
已知甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体。下列说法不正确的是
| A.X是具有极性键的非极性分子 | B.Z是水煤气的主要成分之一 |
| C.甲和X的反应是吸热反应 | D.丙是生产硅的重要原料 |
 2SO3(g)△H<0
2SO3(g)△H<0