题目内容
【题目】如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是

A.升温,反应①的速率减小反应②的速率增大
B.反应①是放热反应
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
【答案】B
【解析】
根据图象①可知,温度越高,平衡常数对数值(lgK) 越小,平衡常数越小,说明升高温度,平衡逆向移动,N2+3H22NH3的正反应是放热反应;同理,②的温度越高,平衡常数越大,说明升高温度,平衡正向移动,N2+O22NO的正反应是吸热反应,据此分析解答。
A.升高温度,无论是放热反应还是吸热反应,反应速率都增大,故A错误;
B.根据上述分析可知,温度越高,①的平衡常数越小,说明升高温度,平衡逆向移动,反应①是放热反应,故B正确;
C.在常温下,反应①的平衡常数虽然很大,但反应速率太慢,不适合工业生产,故C错误;
D.在1000℃时,反应①和反应②的平衡常数对数值(lgK)相等,而不是N2的转化率相等,故D错误;
故选B。

 暑假作业海燕出版社系列答案
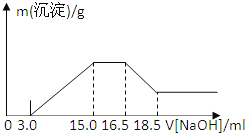
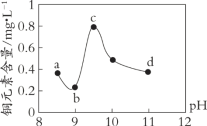
暑假作业海燕出版社系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升