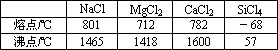题目内容
|
下表给出几种氯化物的熔沸点,对此有下列说法: ①CaCl2属于离子晶体 ②SiCl4是分子晶体 ③1500℃时,NaCl可形成气态分子 ④MgCl2水溶液不能导电
与表中数据一致的说法有 | |
| [ ] | |
A. |
仅① |
B. |
仅② |
C. |
①和② |
D. |
①②③ |
答案:D
解析:
解析:
|
思路解析:考查了不同的晶体类型的物理性质中熔点的差异性比较.分析表中的数据发现,NaCl、MgCl2、CaCl2熔沸点都比较高,所以可能是离子晶体,NaCl在气态时不可能仍以离子形式存在了,只有以中性的分子存在;既然MgCl2是离子晶体,而且它是易溶的盐,所以,它的水溶液是能导电的,而SiCl4的熔沸点很低,则它是分子晶体.再对照,然后对选项进行判断,可以发现只有④MgCl2水溶液不能导电的说法不正确. 绿色通道:解决此题目的关键是要掌握不同的晶体的熔沸点的比较规律和方法.一般而言,晶体之间的熔沸点的高低规律为:除金属外,熔沸点特别高的属于原子晶体,比较高的属于离子晶体,比较低的是分子晶体.而不同的金属晶体熔沸点差别很大,不可一概而论. |

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下表给出几种氯化物的熔沸点
|
下表给出几种氯化物的熔沸点,对此有下列说法:
|
下表给出几种氯化物的熔沸点:对此有下列说法与表中数据一致的说法有( )
|
下表给出几种氯化物的熔点和沸点(*表示在2.5×1.01×105 Pa下测定):
| | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 熔点(℃) | 801 | 714 | 190* | ―68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
A.AlCl3在加热时升华
B.SiCl4晶体属于分子晶体
C.1500℃时NaCl存在气态分子
D.AlCl3晶体是典型的离子晶体
下表给出几种氯化物的熔点和沸点(*表示在2.5×1.01×105 Pa下测定):
|
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
熔点(℃) |
801 |
714 |
190* |
―68 |
|
沸点(℃) |
1465 |
1418 |
180 |
57 |
下列有关叙述,不正确的是
A.AlCl3在加热时升华
B.SiCl4晶体属于分子晶体
C.1500℃时NaCl存在气态分子
D.AlCl3晶体是典型的离子晶体