题目内容
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料 合成尿素的主要步骤如图1所示(图中某些转化步骤未列出).

请回答下列问题:
(1)反应①的离子方程式是______
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是______.
(3)反应②是放热反应,温度升高,该反应的平衡常数______ (填“增大”、“减小”或“不变”).H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是______杂化.
(4)如果整个生产过程釆用绿色化学工艺,则生产 120t尿素理论上需要CH4______m3 (标准状况).
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产 生净化的水又能发电.尿素燃料电池结构如图2所示,工作时负极的电极反应式为______.
解:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾,其离子反应为CO32-+CO2+H2O═2HCO3-,故答案为:CO32-+CO2+H2O═2HCO3-;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S,故答案为:2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小;H2NCOONH4中的C原子上没有孤对电子,成键数为3,C原子采取sp2杂化,
故答案为:减小;sp2;
(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为 ×22.4L/mol×10-3m3=4.48×104m3,故答案为:4.48×104;
×22.4L/mol×10-3m3=4.48×104m3,故答案为:4.48×104;
(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,
故答案为:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
分析:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动;H2NCOONH4中的C原子上没有孤对电子,成键数为3;
(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算;
(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳.
点评:本题以尿素的合成为信息考查化学用语及化学平衡、电化学等知识,综合性较强,题目难度中等,(5)为学生解答的难点和易错点.
(2)Fe2S3和H2O与02反应生成氢氧化铁和S,该反应为2Fe2S3+6H2O+3O2═4Fe(OH)3+6S,故答案为:2Fe2S3+6H2O+3O2═4Fe(OH)3+6S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动,则平衡常数K减小;H2NCOONH4中的C原子上没有孤对电子,成键数为3,C原子采取sp2杂化,
故答案为:减小;sp2;
(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,则生产120t尿素理论上需要CH4为
 ×22.4L/mol×10-3m3=4.48×104m3,故答案为:4.48×104;
×22.4L/mol×10-3m3=4.48×104m3,故答案为:4.48×104;(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,
故答案为:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
分析:(1)反应①发生二氧化碳与碳酸钾溶液反应生成碳酸氢钾;
(2)Fe2S3和H2O与02反应生成氢氧化铁和S;
(3)反应②为合成氨的反应,放热反应,温度升高,平衡逆向移动;H2NCOONH4中的C原子上没有孤对电子,成键数为3;
(4)由C原子守恒可知,CH4~CO2~CO(NH2)2,以此计算;
(5)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳.
点评:本题以尿素的合成为信息考查化学用语及化学平衡、电化学等知识,综合性较强,题目难度中等,(5)为学生解答的难点和易错点.

练习册系列答案
相关题目

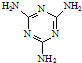 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 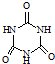 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.