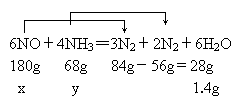题目内容
在一定条件下,NO跟NH3可以发生反应生成N2和H2O,现有NO和NH3的混合物30g,充分反应后所得的产物中,若经还原得到的N2比经氧化得到的N2多1.4g.
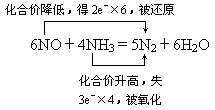
(1)写出反应的化学方程式,并标出电子转移的方向和数目;
(2)若以上反应进行完全,试计算原反应混合物中NO与NN3的质量可能各为多少克?
答案:
解析:
解析:
|
(1) (2)NO:26.6g,NH3:3.4g或NO:9g,NH3:21g. 导解:(1)根据题设条件,其化学方程式用观察法配平(奇数配偶法)为6NO+4NH3=5N2+6H2O (2)设30g NO和NH3的混合物中NO为x,NH3为y,则x+y=30g,由其反应可改写为
若NO过量,则68g:y=28g:1.4g,得y=3.4g,x=26.6g,若NH3过量,则180g:x=28g:1.4g,得x=9g,y=21g. |

练习册系列答案
相关题目