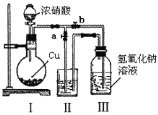
题目内容
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为 。Y、W的氢化物沸点高的是 (写化学式),原因是 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原因 。
(4) Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
【答案】(1)![]() ;
;
(2)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;NH3;分子之间存在氢键;
CO2↑+4NO2↑+2H2O;NH3;分子之间存在氢键;
(3)第三周期第VA;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱;
(4)Al2O3+3C+ N2 ![]() 2AlN+3CO。
2AlN+3CO。
【解析】试题分析:X、Y、Z、W、R是短周期元素,原子序数依次增大,X原子核外各层电子数之比为1:2,X有2个电子层,X是C元素。 Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al元素。(1)元素X的最高价氧化物是CO2,其电子式为![]() ;(2)单质X和元素Y的最高价氧化物对应水化物HNO3的浓溶液在加热时会发生氧化还原反应,产生CO2、NO2和水,发生反应的化学方程式为C+4HNO3(浓)
;(2)单质X和元素Y的最高价氧化物对应水化物HNO3的浓溶液在加热时会发生氧化还原反应,产生CO2、NO2和水,发生反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;N、P是同一主族的元素,元素的氢化物的化学式分别是NH3、PH3,由于在氨的分子之间存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高,所以Y、W的氢化物沸点高的是NH3;(3)元素W是P,在元素周期表中位于第三周期第VA;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱;(4)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+ N2
CO2↑+4NO2↑+2H2O;N、P是同一主族的元素,元素的氢化物的化学式分别是NH3、PH3,由于在氨的分子之间存在氢键,增加了分子之间的吸引力,使物质的熔沸点升高,所以Y、W的氢化物沸点高的是NH3;(3)元素W是P,在元素周期表中位于第三周期第VA;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱;(4)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+ N2 ![]() 2AlN+3CO。
2AlN+3CO。