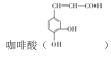
ЬтФПФкШн
ЁОЬтФПЁПЮяжЪдкЫЎжаПЩФмДцдкЕчРыЦНКтЁЂбЮЕФЫЎНтЦНКтКЭГСЕэЕФШмНтЦНКтЃЌЫќУЧЖМПЩПДзїЛЏбЇЦНКтЁЃгаШчЯТЕФA~GЧыИљОнЫљбЇжЊЪЖЛиД№ЃК
(1)AЮЊ0.1 molЁЄLЃ1ЕФ(NH4)2SO4ШмвКЃЌЪЕбщВтЕУAЕФpH<7ЃЌдвђЪЧ(гУРызгЗНГЬЪНБэЪО)ЃК ЃЛдкИУШмвКжаИїжжРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ_______________ЁЃ
(2)BЮЊ0.1 molЁЄLЃ1 NaHCO3ШмвКЃЌЪЕбщВтЕУBЕФpH>7ЃЌЧыЗжЮіBЯдМюадЕФдвђЃК ____________________ЁЃ
(3)CЮЊAl2(SO4)3ШмвКЃЌАбCеєИЩЃЌзЦЩеЃЌзюКѓЕУЕНЕФЙЬЬхВњЮяЪЧ ЁЃШєАбBКЭCЛьКЯЃЌНЋВњЩњАзЩЋГСЕэКЭЮоЩЋЦјЬхЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ__________________ЁЃ
(4)DЮЊCH3COONaШмвКЃЌГЃЮТЯТЃЌpHЃН9ЕФDжаЃЌЫЎЕчРыГіРДЕФc(OHЃ)ЃН________ЁЃ
(5)EЮЊФГХЈЖШЕФNH4ClШмвКЃЌГЃЮТЯТЃЌ ВтЕУИУШмвКЕФpH=5ЃЌаДГіИУШмвКжаЯТСаЫуЪНЕФОЋШЗНсЙћ(СаЪН)ЃКc(Cl-)Ѓc(NH4+)ЃН_____________ mol/LЁЃ
(6)FЮЊMg(OH)2ШмвКЃЌЧѓЪвЮТЯТFБЅКЭШмвКжаMg2+ЕФЮяжЪЕФСПХЈЖШЃН____________ mol/L(вбжЊЪвЮТЪБЃЌMg(OH)2ЕФШмЖШЛ§KspЃН3.2ЁС10-11)ЁЃ
(7)GЮЊСђЛЏФЦШмвКЃЌдкХфжЦGЪБЃЌЮЊСЫЗРжЙЗЂЩњЫЎНтЃЌПЩвдМгШыЩйСПЕФ ЁЃ
ЁОД№АИЁП(1) NH4+ЃЋH2O ![]() NH3ЁЄH2OЃЋHЃЋЃЌc(NH
NH3ЁЄH2OЃЋHЃЋЃЌc(NH![]() )>c(SO
)>c(SO![]() )>c(HЃЋ)>c(OHЃ)
)>c(HЃЋ)>c(OHЃ)
(2)HCO![]() ЕФЕчРыаЁгкЫЎНтЃЌЪЙШмвКжаc(OHЃ)>c(HЃЋ)
ЕФЕчРыаЁгкЫЎНтЃЌЪЙШмвКжаc(OHЃ)>c(HЃЋ)
(3) Al2(SO4)3 Al3ЃЋЃЋ3HCO![]() ===Al(OH)3Ё§ЃЋ3CO2Ёќ
===Al(OH)3Ё§ЃЋ3CO2Ёќ
(4) 10-5 (5)10-5-10-9 (6)c(Mg2+)ЃН2ЁС10-4 mol/L (7)NaOH
ЁОНтЮіЁП
ЪдЬтЗжЮіЃК(1)0.1 molЁЄLЃ1ЕФ(NH4)2SO4ШмвКЃЌвђNH4+ЕФЫЎНтШмвКЕФpH<7ЃЌЫЎНтЗДгІЕФРызгЗНГЬЪНЮЊNH4+ЃЋH2O ![]() NH3ЁЄH2OЃЋHЃЋЃЌяЇИљРызгЫЎНтЮЂШѕЃЌЫљвдЕУЕНШмвКжаЕФРызгХЈЖШДѓаЁЮЊЃКc(NH4+)ЃОc(SO42-)ЃОc(H+)ЃОc(OH-)ЃЛ
NH3ЁЄH2OЃЋHЃЋЃЌяЇИљРызгЫЎНтЮЂШѕЃЌЫљвдЕУЕНШмвКжаЕФРызгХЈЖШДѓаЁЮЊЃКc(NH4+)ЃОc(SO42-)ЃОc(H+)ЃОc(OH-)ЃЛ
(2)дкNaHCO3ШмвКжаДцдкЬМЫсЧтИљРызгЕФЫЎНтЦНКтЮЊЃКHCO3+H2OH2CO3+OH-ЃЌЕчРыЦНКтЮЊЃКHCO3-H++CO32-ЃЛЖјвдЫЎНтЮЊжїЃЌМДЬМЫсЧтИљРызгЕФЫЎНтГЬЖШДѓгкЕчРыГЬЖШШмвКЃЌЙЪЯдМюадЃЛ
(3)вђAl2(SO4)3дкЫЎШмвКжаЫЎНтЩњГЩЕФЫсЮЊФбЛгЗЂадЫсЃЌЙЪАбAl2(SO4)3ШмвКеєИЩЃЌзЦЩеЃЌзюКѓЕУЕНЕФЙЬЬхВњЮяЪЧAl2(SO4)3 ЁЃШєАбAl2(SO4)3 КЭNaHCO3ШмвКЛьКЯЃЌвђЫЋЫЎНтЗДгІНЋВњЩњАзЩЋГСЕэКЭЮоЩЋЦјЬхЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊAl3++3HCO3-=Al(OH)3Ё§+3CO2ЁќЃЛ
(4)дкCH3COONaШмвКжаЃЌOH-ШЋВПРДздгкЫЎЕФЕчРыЃЌгЩгкШмвКЕФpH=9ЃЌЙЪШмвКжаЕФЧтРызгХЈЖШЮЊ10-9mol/LЃЌгЩЫЎЕчРыГіРДЕФc(OH-)=10-14ЁТ10-9=1.0ЁС10-5molL-1ЃЛ
(5)дкNH4ClШмвКжаДцдкЕчКЩЪиКуЪНc(NH4+)+c(H+)=c(Cl-)+c(OH-)ЃЌдђc(Cl-)Ѓc(NH4+)ЃНc(H+)-c(OH-)=(10-5-10-9)mol/LЃЛ
(6)вбжЊKsp=c(M2+)ЁСc2(OH-)ЃЌЧвжЛгаM(OH)2ЕФБЅКЭШмвКжаЃЌ2c(Mg2+)=c(OH-)ЃЌЩшc(M2+)=xЃЌдђc(OH-)=2xЃЌМДxЁС(2x)2=3.2ЁС10-11ЃЌНтx=![]() =2ЁС10-4ЃЌc(OH-)=4ЁС10-4mol/LЃЌc(Mg2+)=2ЁС10-4mol/LЃЛ
=2ЁС10-4ЃЌc(OH-)=4ЁС10-4mol/LЃЌc(Mg2+)=2ЁС10-4mol/LЃЛ
(7)СђЛЏФЦШмвКжаДцдкS2-ЕФЫЎНтЃЌдкХфжЦСђЛЏФЦЪБЃЌЮЊСЫЗРжЙЗЂЩњЫЎНтЃЌПЩвдМгШыЩйСПЕФNaOHШмвКЁЃ