题目内容
13.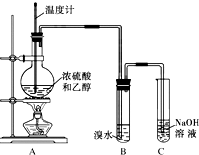 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.(1)甲设计了如图所示的实验装置,并进行实验.当温度升至170℃左右时,有大量气体产生,溴水的颜色迅速褪去.甲认为达到了实验目的.请写出甲实验中两个主要反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2 →CH2BrCH2Br.烧瓶中除加入浓硫酸和无水乙醇外,还需要加入碎瓷片(或沸石).装置中氢氧化钠溶液的作用是吸收尾气,防止污染.
(2)乙考察了甲的实验过程,发现下列两个问题:
①当温度升到160℃左右时混合液呈黑色,在超过170℃后生成气体的速率明显加快并有刺激性气味的气体生成.则乙同学观察到的黑色物质是C,刺激性气味的气体是SO2.
②当一定量的溴水中的溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多.如果装置的气密性没有问题,则其可能的原因是乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃可以生成乙醚、乙烯通入速率过快.
(3)丙为验证生成的气体与溴水的反应是加成而不是取代,提出甲的装置必须先作“在A、B之间增加一个装有烧碱溶液的洗气装置后再开始加热”的改进,然后用pH试纸来测试反应后B中溶液的酸性即可验证,则丙提出的增加一个洗气装置的理由是除去二氧化硫等酸性气体,此时用pH试纸来进行实验能够达到实验目的原因是如果发生了取代反应,则B中溶液的酸性增强.丙认为按甲的装置进行实验,烧瓶内混合液在实验过程中可能还有另外两种气体产生,这两种气体是CO2、SO2.
分析 (1)根据题中实验目的和实验装置可知,乙醇在浓硫酸作用下加热发生消去反应得乙烯,乙烯通过溴水溶液,与溴发生加成反应得1,2-二溴乙烷,给液体加热要加入沸石,防止瀑沸,溴水的溴易挥发,所以尾气要用氢氧化钠溶液吸收;
(2)浓硫酸具有脱水性,在加热时容易使乙醇脱水生成碳,碳中加热时可与浓硫酸发生反应生成二氧化碳和二氧化硫,乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃还可以生成乙醚,乙烯通入速率过快也会使消耗乙醇量增加;
(3)要验证生成的气体与溴水的反应是加成而不是取代,在A、B之间增加一个装有烧碱溶液的洗气装以除去发生装置中产生的二氧化硫等酸性气体对实验的干扰,然后用pH试纸来测试反应后B中溶液的酸性即可验证,如果B中溶液的酸性增强,则发生了取代反应,如果B中溶液的酸性没有明显增强,则发生加成反应,结合(2)的分析进行答题.
解答 解:(1)根据题中实验目的和实验装置可知,乙醇在浓硫酸作用下加热发生消去反应得乙烯,反应的方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,乙烯通过溴水溶液,与溴发生加成反应得1,2-二溴乙烷,反应的方程式为CH2=CH2+Br2 →CH2BrCH2Br,给液体加热要加入碎瓷片(或沸石),防止瀑沸,溴水的溴易挥发,所以尾气要用氢氧化钠溶液吸收,防止污染空气,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2+Br2 →CH2BrCH2Br;碎瓷片(或沸石);吸收尾气,防止污染;
(2)①浓硫酸具有脱水性,在加热时容易使乙醇脱水生成碳,所以乙同学观察到的黑色物质是碳,碳加热时可与浓硫酸发生反应生成二氧化碳和二氧化硫,其中二氧化硫有刺激性气味,
故答案为:C;SO2;
②乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃还可以生成乙醚,乙烯通入速率过快也会使消耗乙醇量增加,
故答案为:乙醇在浓硫酸、加热的条件下如果温度不能迅速达到170℃可以生成乙醚、乙烯通入速率过快;
(3)要验证生成的气体与溴水的反应是加成而不是取代,在A、B之间增加一个装有烧碱溶液的洗气装以除去发生装置中产生的二氧化硫等酸性气体对实验的干扰,然后用pH试纸来测试反应后B中溶液的酸性即可验证,如果B中溶液的酸性增强,则发生了取代反应,如果B中溶液的酸性没有明显增强,则发生加成反应,根据(2)①中的分析可知,烧瓶内混合液在实验过程中可能还有另外两种气体产生,这两种气体是CO2、SO2,
故答案为:除去二氧化硫等酸性气体;如果发生了取代反应,则B中溶液的酸性增强;CO2、SO2.
点评 本题考查了物质组成成份的实验方案设计和分析判断,主要考查乙醇、乙烯、碳、浓硫酸等物质的性质应用,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.

(1)为达到本实验目的其装置连接顺序为:a连c,b连d.
(2)实验开始后,锥形瓶中发生反应的离子方程式为Zn+2H+═Zn2++H2↑.
(3)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸溶液和4mol/L硫酸溶液,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
(4)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快.
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量(任写一种).
①碳酸 ②乙醇 ③苯酚 ④乙酸
Ⅰ甲同学设计并实施了如下实验方案.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4中溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量②③两 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的溶液的酸性 | 略 | CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:由强到弱顺序(填序号) | |||
利用上述仪器组装实验装置,其中A管插入(填字母,下同)D(或E)中,B管插入E(或D)中,C管插入F中.
Ⅲ丙同学认为乙同学的实验设计不完善,请说明不完善的理由因乙酸有挥发性,制得的CO2中含有乙酸,如何改正才能使乙同学的实验设计更加完善,请说明在试管F之前增加了一个盛有饱和NaHCO3溶液的洗气装置.


| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,C2H4使B中溶液褪色的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br.
②乙根据现象c认为产生了SO2,SO2使B中溶液褪色的化学方程式是SO2+Br2+2H2O=2HBr+H2SO4.
(3)为证实各自观点,甲、乙同学重新实验,各自在A、B间增加一个装有某种试剂的洗气瓶,均观察到溴水褪色.
①根据甲的设计,洗气瓶中盛放的试剂是NaOH溶液.
②乙为进一步验证其观点,取少量反应后的B中溶液,加入少量BaCl2溶液,振荡,产生大量白色沉淀,反应的离子方程式为SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.
