题目内容
2.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 25℃,1.01×105Pa,16gO2和O3的混合气体中含有的原子数NA | |
| C. | 常温下,5.6g铁完全溶解于稀盐酸,铁失去的电子数为0.3 NA | |
| D. | 标准状况下,22.4LN2和CO混合气中含4NA个原子 |
分析 A.标况下四氯化碳的状态不是气体;
B.根据n=$\frac{m}{M}$计算出混合物中含有氧原子的物质的量;
C.铁与稀盐酸反应生成的是亚铁离子;
D.氮气和一氧化碳都是双原子分子,1mol该混合气体中含有2mol原子.
解答 解:A.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.16gO2和O3的混合气体中含有O的物质的量为:$\frac{16g}{16g/mol}$=1mol,含有的原子数为NA,故B正确;
C.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1mol铁与稀盐酸完全反应生成0.2mol电子,铁失去的电子数为0.2 NA,故C错误;
D.标准状况下,22.4LN2和CO混合气的物质的量为1mol,1mol该混合气体中含有2mol原子,含2NA个原子,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
12.能用离子方程式“H++OH-═H2O”表示的化学反应是( )
| A. | 4HNO3$\frac{\underline{\;光照\;}}{\;}$2H2O+4H2O↑+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | CaCO3+2HCl═CaCl2+CO2↑+H2 | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
13.下列过程与加成反应有关的是( )
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙烯与溴水混合振荡,水层颜色变浅 | |
| C. | 乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅 | |
| D. | 甲烷与氯气混合光照,气体颜色变浅 |
10.在蒸发皿中蒸干下列物质的溶液,不能得到该物质固体的是( )
| A. | MgCl2 | B. | Fe2(SO4)3 | C. | K2CO3 | D. | NaCl |
17.已知:将Cl2通入适量浓NaOH溶液恰好完全反应,产物中可能有NaCl、NaClO、NaClO3、且$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是( )
| A. | 参加反应的氯气的物质的量为6a mol | |
| B. | 改变温度,产物中NaCl的最小理论产量为4a mol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol | |
| D. | 某温度下,若反应后$\frac{{c(C{l^-})}}{{c(Cl{O^-})}}$=6,则溶液中$\frac{{c(C{l^-})}}{c(ClO_3^-)}=\frac{1}{2}$ |
14.下列关于有机化合物说法正确的是( )
| A. | 可用高锰酸钾溶液鉴别甲苯、环己烯与溴苯 | |
| B. | 淀粉与纤维素互为同分异构体,二者水解的最终产物相同 | |
| C. | 石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程 | |
| D. | 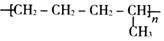 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 是由单体CH2=CH-CH3和CH2=CH2发生加聚反应的产物 |