题目内容
1. 去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
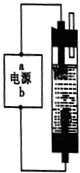
去年5月12日四川汶川发生特大地震后为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.(一)甲同学用石墨作电极和饱和氯化钠水设计如图的制作消毒液(NaClO溶液)的发生器,通电时,电解饱和氯化钠水的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;为使生成的Cl2被完全吸收,则电源的a极为负极(填“正”、“负”),溶液中生成NaClO的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O.
(二)乙同学从某超市查询到某品牌消毒液包装说明的部分内容:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.本品须密封,置阴凉暗处保存.
(1)室温时,他测得该消毒液(NaClO)的pH>7,其原因为(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)该消毒液还具有的化学性质有AD(填序号).
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性
(3)从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)2NaClO+H2O+CO2═Na2CO3+2HClO、(2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑).
分析 (一)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;为使生成的Cl2完全被吸收,则氢氧化钠和氯气的接触面积要大且接触时间要长,则在连接b的电极上生成氯气,连接a的电极上生成氢气;氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(二)(1)次氯酸钠是强碱弱酸盐,阴离子易水解而使其溶液呈碱性;
(2)次氯酸钠具有强氧化性且不稳定;
(3)次氯酸的酸性小于碳酸.
解答 解:(一)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
为使生成的Cl2完全被吸收,则氢氧化钠和氯气的接触面积要大且接触时间要长,则在连接b的电极上生成氯气,连接a的电极上生成氢气,所以a是负极;
氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;负;Cl2+2OH-═Cl-+ClO-+H2O;
(二)(1)次氯酸钠是强碱弱酸盐,阴离子易水解而使其溶液呈碱性,水解方程式为ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(2)在消毒液中,次氯酸钠具有氧化性,还具有漂白性,
故答案为:AD;
(3)次氯酸的酸性小于碳酸,根据强酸制取弱酸知,次氯酸钠易和二氧化碳、水反应生成次氯酸,2NaClO+H2O+CO2═Na2CO3+2HClO,次氯酸不稳定,易分解,所以次氯酸钠易失效,
故答案为:2NaClO+H2O+CO2═Na2CO3+2HClO、(2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑).
点评 本题考查了电解原理、次氯酸钠的性质,明确离子放电顺序及电极上发生的反应是解本题关键,注意水解方程式要写可逆号,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 溶质的质量分数是25% | |
| B. | 溶质的物质的量浓度是1.10 mol•L-1 | |
| C. | 溶质和溶剂的物质的量之比是1:50 | |
| D. | 硫酸根离子的质量分数是9.60% |

| A. | 反应前后分子种类不发生改变 | |
| B. | 反应前后原子的种类与数目发生改变 | |
| C. | 反应前两种分子的个数比是1:2 | |
| D. | 该反应的基本类型是化合反应 |
| A. | 在燃煤中加入石灰石可减少SO2排放,发生的反应为:2CaCO3=2SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+2CaSO4 | |
| B. | C02通入水玻璃可以得到硅酸沉淀 | |
| C. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| D. | 氢氟酸能够雕刻玻璃,故不能用玻璃瓶来盛装氢氟酸 |
 分子式为C3H9N的有机物有(不考虑立体异构)( )
分子式为C3H9N的有机物有(不考虑立体异构)( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 将CO中毒者移至通风处抢救 | |
| B. | 误食硫酸铜溶液,可服用氢氧化钠溶液解毒 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
| A. | 500 mL容量瓶 | B. | 胶头滴管 | C. | 分液漏斗 | D. | 烧杯 |