题目内容
15.将11.0g铁粉和铝粉的混合物投入500mL2.0mol/LH2SO4中,充分反应后,产生的气体在标准状况下体积为8.96L,试完成下列各小题.(1)写出有关反应的化学方程式;
(2)该铁粉和铝粉的混合物能(填“能”或“不能”)完全溶解;
(3)该混合物中铁粉物质的量是0.1mol.
分析 (1)铝与硫酸反应生成硫酸铝和氢气,铁与稀硫酸反应生成硫酸亚铁和氢气,据此写出反应的化学方程式;
(2)根据n=cV计算出硫酸的物质的量,再计算出含有氢离子的物质的量,利用氢元素守恒判断硫酸是否过量;
(3)设出混合物中铁和铝的物质的量,分别根据总重量、生成氢气的量列式计算出铝、铁的物质的量.
解答 解:(1)铁粉、铝粉与硫酸反应的化学方程式分别为:Fe+H2SO4=FeSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑,
答:发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑;
(2)标准状况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,根据氢元素守恒可知生成0.4mol氢气需要消耗0.8mol氢离子,
500mL2.0mol/LH2SO4中含有硫酸的物质的量为:2.0mol/L×0.5L=1mol,1mol硫酸能够提供2mol氢离子,
所以硫酸过量,金属完全溶解,
故答案为:能;
(3)设混合物中含有铁、铝的物质的量分别为x、y,
根据金属总重量、生成氢气的物质的量可得:$\left\{\begin{array}{l}{56x+27y=11}\\{x+\frac{3}{2}y=0.4}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.1mol}\\{y=0.2mol}\end{array}\right.$,
所以混合物中含有0.2mol铝、0.1mol铁,
故答案为:0.1.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

D(g)+B(g)=E(g)△H=-Q2KJ/mol,
且Q1大于Q2,若A和D的混合气体1mol完全与B反应放出的热量为Q3KJ,则A与D的物质的量之比为( )
| A. | (Q2-Q1):(Q1-Q3) | B. | (Q3-Q2):(Q1-Q3) | C. | (Q3-Q2):(Q3-Q1) | D. | (Q1-Q2):(Q3-Q1) |
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )| A. | +882 kJ•mol-1 | B. | +441 kJ•mol-1 | C. | -882 kJ•mol-1 | D. | -441 kJ•mol-1 |
| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| D. | 肌醇 与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 |

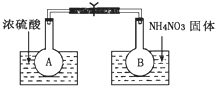 已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
