题目内容
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| B. | 标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA | |
| D. | 反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
分析 A、甲醛和冰醋酸的最简式为CH2O,3.0g混合物中含有0.1mol最简式;
B、标况下,苯为液态;
C、根据n=cV计算出溶质硫酸铝钾的物质的量,铝离子部分水解,导致阳离子数目增多;
D、I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-.
解答 解:A、3.0g含甲醛的冰醋酸中含有0.1mol最简式CH2O,含有0.4mol原子,含有的原子总数为0.4NA,故A正确;
B、标况下,苯为液态,故不能根据气体摩尔体积来计算,故B错误;
C、1L 0.01mol•L-1 KAl(SO4)2溶液中含有0.01mol硫酸铝钾,由于铝离子部分水解,则溶液中含有的阳离子的物质的量大于0.02mol,含有的阳离子数目大于0.02 NA,故C错误;
D、在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E在周期表中位于第四周期第ⅠB族
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
15.石墨烯的结构示意图如图所示,下列说法正确的是( )
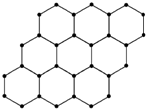

| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
19.下列单质或化合物性质的描述正确的是( )
| A. | Na2CO3的溶解性比NaHCO3小 | |
| B. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
9.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.现进行如图所示实验.下列有关说法正确的是( )
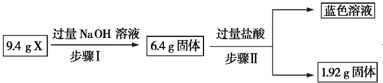

| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
16.仅用下表提供的仪器(夹持仪器和试剂任选)不能达到相应实验目的一组是( )
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
1.电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板蚀刻液.某探究小组设计如下线路处理废液和资源回收:
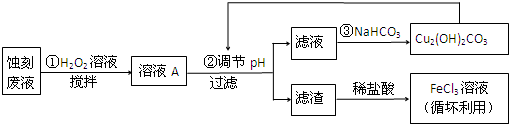
请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是3.2≤pH<4.7.
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.

请回答:
(1)FeCl3-HCl溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+、Fe2+和Cu2+.
(2)FeCl3蚀刻液中加入盐酸的目的:可以抑制氯化铁水解,又可提高蚀刻速率.
(3)步骤①中加入H2O2溶液的目的是因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
(4)已知:
生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)写出步骤②中生成CO2的一个离子方程式4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3不易溶于水).
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3-=Cu2(OH)2CO3↓+H2O+3 CO2↑.
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.