题目内容
【题目】[物质结构与性质]
丁二酮肟![]() 是检验Ni2+的灵敏试剂。
是检验Ni2+的灵敏试剂。
(1)Ni2+基态核外电子排布式为 。丁二酮肟分子中C原子轨道杂类型为 ,1mol丁二酮肟分子所含![]() 键的数目为 。
键的数目为 。
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点-19.3℃,沸点42.1℃,易溶于有机溶剂。
①Ni(CO)4固态时属于 晶体(填晶体类型)。
②与CO互为等电子体的阴离子为 (填化学式)。
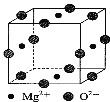
(3)Ni2+与Mg2+、O2—形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 。
【答案】(1)[Ar]3d8 sp3和sp2 15mol(或15×6.02×1023)
(2)①分子 ②CN- (3)Mg2NiO3
【解析】
试题分析:A.(1)Ni是28号元素,基态原子电子派不是为:[Ar]3d84s2 ,Ni2+基态电子排布是为:[Ar]3d8 ;丁二酮肟![]() 分子中甲基上的C原子价层有4对б电子,所以杂化方式为sp3,除两个甲基上的C原子外,剩下的两个C原子上有3对б电子和一对∏电子,所以为sp2杂化;单间都是
分子中甲基上的C原子价层有4对б电子,所以杂化方式为sp3,除两个甲基上的C原子外,剩下的两个C原子上有3对б电子和一对∏电子,所以为sp2杂化;单间都是![]() ,双键和三键中有一个是б键,所以1mol丁二酮肟分子含有б键的数目为15mol,答案为:[Ar]3d8 sp3和sp2 15mol(或15×6.02×1023);(2)①四羰基镍熔点-19.3℃,沸点42.1℃,四羰基镍的熔沸点低,且易溶于有机溶剂,所以四羰基镍为分子晶体,答案为:分子;②CO分子为2原子14电子,与CO互为等电子体的是CN-,答案为:CN-;(3)O2—在棱上,每一个阳离子四个晶胞共用,所以阳离子的个数为
,双键和三键中有一个是б键,所以1mol丁二酮肟分子含有б键的数目为15mol,答案为:[Ar]3d8 sp3和sp2 15mol(或15×6.02×1023);(2)①四羰基镍熔点-19.3℃,沸点42.1℃,四羰基镍的熔沸点低,且易溶于有机溶剂,所以四羰基镍为分子晶体,答案为:分子;②CO分子为2原子14电子,与CO互为等电子体的是CN-,答案为:CN-;(3)O2—在棱上,每一个阳离子四个晶胞共用,所以阳离子的个数为![]() ,镁离子位于面心上,每一个镁离子两个晶胞共用,镁离子的个数为
,镁离子位于面心上,每一个镁离子两个晶胞共用,镁离子的个数为![]() ,根据电荷守恒可知Ni2+的个数为1 ,所以该晶体的化学式为Mg2NiO3,答案为:Mg2NiO3。
,根据电荷守恒可知Ni2+的个数为1 ,所以该晶体的化学式为Mg2NiO3,答案为:Mg2NiO3。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
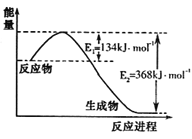
(1)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g)![]() 2NH3(g)△H <0,
2NH3(g)△H <0,
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1) | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+ c(H+)= c(Cl-)+ c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)

