题目内容
铁在热稀硝酸中反应,其主要产物为N2O,在冷的稀硝酸中反应,其主要产物为NO,当溶液变稀时,其主要产物为
(1)假设在任一气体产生的曲线段内,只有一种还原产物,配平b点到c点时反应的方程式_______Fe+_______HNO3![]() _______Fe(NO3)3+_______+_______H2O;
_______Fe(NO3)3+_______+_______H2O;
(2)判断由O点到a点的还原产物是_______;
(3)由a点到b点的还原产物是_______,原因是_______;
(4)已知到达d点时反应完全结束,此时溶液中的主要阳离子为_______,分析投入铁的物质的量之比n(c):n(d)=_______。
(1)8 30 8 3NH4NO3 9
(2)NO
(3)N2O 反应放热,使溶液温度升高
(4)Fe2+、![]() 2:3
2:3
【解析】本题考查铁与硝酸的反应,较难题。图象中:Oa段产物为NO,ab段产物为N2O,bc段产物为![]() ,cd段H+耗尽无气体产生,是Fe与Fe(NO3)3反应,气体总体积为一定值。(1)根据得失电子守恒配平:8Fe+30HNO3
,cd段H+耗尽无气体产生,是Fe与Fe(NO3)3反应,气体总体积为一定值。(1)根据得失电子守恒配平:8Fe+30HNO3![]() 8Fe(NO3)3+3NH4NO3+9H2O。(2)O点到a点,为冷的稀硝酸,还原产物为NO。(3)因为反应为放热反应,a点到b点,为热的稀硝酸,还原产物为N2O。(4)c点到d点,发生Fe与Fe(NO3)3反应,溶液中的主要阳离子为Fe2+。根据2Fe3++Fe
8Fe(NO3)3+3NH4NO3+9H2O。(2)O点到a点,为冷的稀硝酸,还原产物为NO。(3)因为反应为放热反应,a点到b点,为热的稀硝酸,还原产物为N2O。(4)c点到d点,发生Fe与Fe(NO3)3反应,溶液中的主要阳离子为Fe2+。根据2Fe3++Fe![]() 3Fe2+,nc(Fe):nd(Fe)=2:3。
3Fe2+,nc(Fe):nd(Fe)=2:3。

(12分)硫酸铜、硝酸铁都是重要的化工原料。
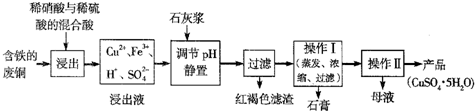
(1)以下是某工厂用含铁的废铜为原料生产胆巩(CuSO4·5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(∥100g水)见下表。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式 ;
③操作I的温度应该控制在 左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液 、 、洗涤、干燥。
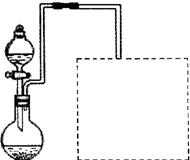
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用
仪器和加热装置未画出)。
①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内。该实验中对圆底烧瓶加热的最佳方式是 加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体)。