题目内容
1.某合金2.25克与足量稀硝酸反应得到标准状况下的气体1.12升,则该合金可能为( )| A. | 锌铁 | B. | 铁铝 | C. | 铁铜 | D. | 不能确定 |
分析 某合金2.25克与足量稀硝酸反应得到标准状况下的气体1.12升,气体物质的量n=$\frac{1.12L}{22.4L/mol}$=0.05mol,转移电子总数为0.05mol×(5-2)=0.15mol,则合金金属的平均摩尔质量=$\frac{2.25g}{0.15mol}$=15g/mol,据此计算各组金属的平均摩尔电子质量比较分析判断.
解答 解:某合金2.25克与足量稀硝酸反应得到标准状况下的气体1.12升,气体物质的量n=$\frac{1.12L}{22.4L/mol}$=0.05mol,转移电子总数为0.05mol×(5-2)=0.15mol,则合金金属的平均摩尔质量=$\frac{2.25g}{0.15mol}$=15g/mol,
A.Zn的电子摩尔质量=$\frac{65}{2}$=32.5g/mol,Fe的摩尔电子质量=$\frac{56}{3}$=18.7g/mol,二者不可以平均到15g/mol,故A错误;
B.Fe的摩尔电子质量=$\frac{56}{3}$=18.7g/mol,Al的摩尔电子质量=$\frac{27}{3}$=9g/mol,二者可以平均到15g/mol,故B正确;
C.Fe的摩尔电子质量=$\frac{56}{3}$=18.7g/mol,Cu的摩尔电子质量=$\frac{64}{2}$32g/mol,二者不可以平均到15g/mol,故C错误;
D.上述分析可知能确定,故D错误;
故选B.
点评 本题考查了金属和酸反应过程中电子守恒的计算,主要是平均摩尔电子质量的计算应用,掌握基础是解题关键,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 都易溶于水 | B. | 苯易与液溴发生加成反应 | ||
| C. | 乙酸溶液显酸性 | D. | 乙醇不能与金属钠反应 |
 某化学兴趣小组设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以在II中收集H2等气体,但不能收集HCl气体 | |
| B. | 若装置II中装满水后,可以收集O2、NO等气体,但不能收集NO2、CO2等气体 | |
| C. | 利用I、Ⅲ装置(K1关闭、K2打开,A中装硝酸)可以比较N、C、Si元素非金属性强弱 | |
| D. | 若在Ⅲ装置的小试管C中加入一定量CCl4和AgNO3溶液(导管伸入CCl4层),则利用I、Ⅲ装置(K1关闭、K2打开)可验证苯与液溴发生的是取代反应,不是加成反应 |
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 浓硝酸和稀硝酸都具有强氧化性 | 浓硝酸和稀硝酸均可使紫色石蕊试液先变红后褪色 |
B | 浓硫酸具有强氧化性和吸水性 | 浓硫酸可干燥H2和CO,不可干燥 SO2和NH3 |
C | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
D | 铵盐受热易分解 | NH4Cl和NH4HCO3均可用作氮肥和制取氨气 |
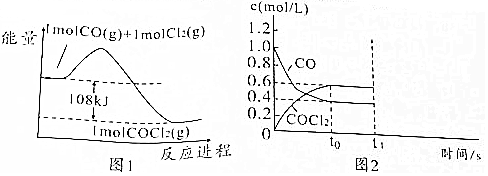
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2; 电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题.
电化学与我们的生活有着密切的联系,请结合电化学知识回答下列有关问题. R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
 l2O7、P2O5、SO3、CO2均属于酸性氧化物
l2O7、P2O5、SO3、CO2均属于酸性氧化物