题目内容
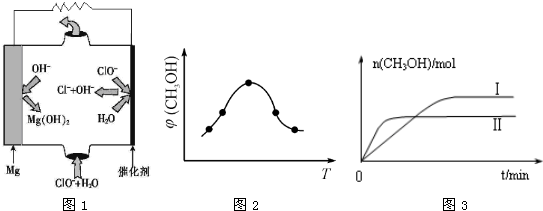
镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是

- A.该电池中镁为负极,发生还原反应
- B.电池工作时,OH-向正极移动
- C.电池工作时,正极周围溶液的pH将不断变小
- D.该电池的总反应式为:Mg+ClO-+H2O=Mg(OH)2↓+Cl-
D
试题分析:A、负极发生氧化反应,错误;B、原电池原理中,阴离子向负极移动,阳离子向正极移动,错误;C、电池工作是,在正极附近生成OH-,故pH增大,错误;D、电池总反应,正确。
考点:考查原电池(燃料电池)基本原理,涉及电极判断、电极反应书写、离子流动等相关知识。
试题分析:A、负极发生氧化反应,错误;B、原电池原理中,阴离子向负极移动,阳离子向正极移动,错误;C、电池工作是,在正极附近生成OH-,故pH增大,错误;D、电池总反应,正确。
考点:考查原电池(燃料电池)基本原理,涉及电极判断、电极反应书写、离子流动等相关知识。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
 (2013?安徽模拟)镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( )
(2013?安徽模拟)镁_次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-=Cl-+2OH-,关于该电池的叙述正确的是( ) 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写: Al(OH)3+3HCl
Al(OH)3+3HCl