题目内容
1.能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.
请回答下列问题:
(1)在“图1”中,曲线b(填“a”或“b”)表示使用了催化剂;该反应属于放热(填“吸热”或“放热”)反应.
(2)根据“图2”判断,下列说法不正确的是AB
A.起始充入的CO为1mol B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=0.15moL/(L•min);该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为12 (具体数值).若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将减小(填“增大”、“减小”或“不变).
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2).
(5)科学家常用量热计(填仪器名称)来直接测定某一反应的反应热.在实验过程中需用环形玻璃搅拌棒不断搅拌,请写出使用环形玻璃搅拌棒搅拌溶液时的操作方法上下移动.
分析 (1)加入催化剂,可降低反应的活化能;由图可知,反应物的总能量大于生成物的总能量,则反应为放热反应,
(2)A.CO的起始浓度为1moL/L,体积为2L,根据n=cV计算CO起始物质的量;
B.增加CO浓度,平衡向正方向移动,H2的转化率增大,自身转化率降低;
C.由于反应前后气体的体积不等,则容器中压强恒定时,反应已达到平衡状态;
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,相当于在原来的基础上缩小体积,压强增大,平衡向正反应方向移动;
(3)10min到达平衡,平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,则△c(CO)=0.75mol/L,△c(H2)=2△c(CO)=1.5mol/L,平衡时c(H2)=$\frac{4mol}{2L}$-1.5mol/L=0.5mol/L,
根据v=$\frac{△c}{△t}$计算(H2),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
正反应为放热反应,若保持其它条件不变,将反应体系升温,平衡逆向移动;
(4)增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低;
(5)科学家常用量热计来直接测定某一反应的反应热.在实验过程中需用环形玻璃上下移动搅拌溶液.
解答 解:(1)由图象可知b活化能较低,应加入催化剂,由图可知,反应物的总能量大于生成物的总能量,则反应为放热反应,故答案为:b;放热;
(2)A.CO的起始浓度为1moL/L,体积为2L,则起始充入的CO为2mol,故A错误;
B.增加CO浓度,平衡向正方向移动,H2的转化率增大,CO的转化率降低,故B错误;
C.由于反应前后气体的体积不等,则容器中压强恒定时,反应已达到平衡状态,故C正确;
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,相当于在原来的基础上缩小体积,压强增大,平衡向正反应方向移动,则平衡时n(CH3OH)/n(CO)会增大,故D正确.
故答案为:AB;
(3)10min到达平衡,平衡时c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,则△c(CO)=0.75mol/L,△c(H2)=2△c(CO)=1.5mol/L,平衡时c(H2)=$\frac{4mol}{2L}$-1.5mol/L=0.5mol/L,
则v(H2)=$\frac{1.5mol/L}{10min}$=0.15moL/(L•min),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.75}{0.25×0.{5}^{2}}$=12;
正反应为放热反应,若保持其它条件不变,将反应体系升温,平衡逆向移动,则该反应的化学平衡常数将减小,
故答案为:0.15moL/(L•min);12;减小;
(4)增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为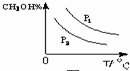 ,故答案为:
,故答案为: ;
;
(5)科学家常用量热计来直接测定某一反应的反应热.在实验过程中需用环形玻璃上下移动搅拌溶液,故答案为:量热计;上下移动.
点评 本题考查化学平衡的计算及影响因素、化学反应与能量变化等问题,题目难度中等,注意反应热定量测定实验.

| A. | BaCl2→NaCl | B. | KMnO4→MnO2 | C. | Na2CO3→NaOH | D. | CuO→Cu(OH)2 |

已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为KSCN溶液.
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净.“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是氢氧化铁.
(3)①写出“还原”时反应Ⅱ的离子方程式:2Fe3++S2-=2Fe2++S↓.
②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
| A. | NaCl晶体 硫酸铜 | B. | 铝 二氧化硫 | ||
| C. | 液态的醋酸 蔗糖 | D. | 熔融的KNO3 硫酸溶液 |
| 弱酸 | CH3COOH | HCN | H2CO3 | NH3•H2O |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 1.8×l0-5 |
| A. | CN-+H2O+CO2=HCN+HCO3- | |
| B. | 物质的量浓度相等的溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 中和等体积、等pH的CH3HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4 溶液显中性 |
