题目内容
8.下列各原子或离子的电子排布式错误的是( )| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
分析 原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布最多应为3s23p6,据此分析解答.
解答 解:A.Si原子核外有14个电子,核外电子排布式为:1s22s22p63s23p2,故A错误;
B.O原子核外有8个电子,O2-核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故B正确;
C.Na的原子序数为11,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
D.Al原子核外有13个电子,Al原子核外电子排布式为1s22s22p63s23p1,故D正确;
故选A.
点评 本题考查了原子或离子核外电子排布,明确排布规律及其规则是解本题关键,为考试热点,知道每个能级最多排列的电子数,要遵循构造原理,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
18.下列各表述与下图所示一致的是( )
| A. | 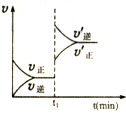 表示某吸热反应t1时刻升高温度时,正逆反应速率的变: | |
| B. | 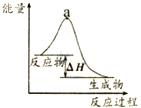 表示某放热反应过程的能量变化,若使用催化剂,a点会降低 | |
| C. | 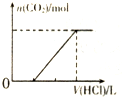 表示向含等物质的量的NaOH、Na2CO3混合溶液中滴加0.1 mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 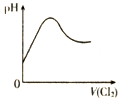 表示Cl2通入H2SO3溶液中pH的变化 |
19.下列各组中的离子,能在溶液中大量共存的是( )
| A. | H+、Na+、CO32-、Cl- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | K+、H+、SO42-、OH- | D. | Ag+、Al3+、NO3-、H+ |
16.铀是自然界中能够找到的最重元素.地球上存量最多的是92238U,关于92238U下列说法正确的是( )
| A. | 铀原子的中子数为238 | |
| B. | 铀原子的中子数与质子数之差为142 | |
| C. | 铀原子的电子数为92 | |
| D. | 92235U与92238U互为同素异形体 |
3.某气体中可能含NH3.HI.Cl2.CO2中一种或几种.将该气体通入硝酸银溶液产生黄色沉淀;将该气体通入澄清石灰水未观察到白色沉淀,则该气体( )
①一定含有HI ②一定不含CO2 ③可能含有CO2④一定不含NH3 ⑤一定不含Cl2.
①一定含有HI ②一定不含CO2 ③可能含有CO2④一定不含NH3 ⑤一定不含Cl2.
| A. | ①②④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
20.下列物质中硫元素只显示氧化性的是( )
| A. | HgS | B. | SO2 | C. | S | D. | H2SO4 |
17.褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到.下列说法不正确的是( )


| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 | |
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 | |
| C. | 在一定条件下,色氨酸可发生缩聚反应 | |
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
18.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示.下列说法正确的是( )


| A. | 虚线右上方的元素为均为金属元素 | |
| B. | 紧靠虚线两侧的元素都是两性金属元素 | |
| C. | 可在虚线附近寻找半导体材料(如Ge、Si等) | |
| D. | 可在虚线的右上方,可寻找耐高温材料 |