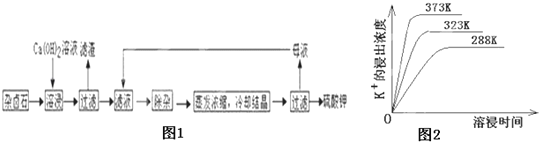
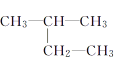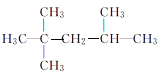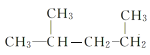题目内容
【题目】下列说法正确的是
A.乳酸薄荷醇酯( ![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B.乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C.麦芽糖和纤维二糖水解后都只得到葡萄糖
D.检验某溶液中是否含有甲醛:在盛有2 mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热
【答案】C
【解析】
A含-COOC-可发生水解,含-OH可发生氧化、消去反应,且含-OH能与Na反应等;
B.关键乙醛和丙烯醛的结构及二者与氢气反应产物判断是否属于同系物;
C. 麦芽糖和纤维二糖水解后都只得到葡萄糖;
D.加入氢氧化钠较少,应在碱性条件下反应。
A.乳酸薄荷醇酯( ![]() )能发生水解、氧化、消去反应,还能够发生取代反应(H氢原子被卤素原子取代),故A错误;
)能发生水解、氧化、消去反应,还能够发生取代反应(H氢原子被卤素原子取代),故A错误;
B.乙醛和丙烯醛(![]() )的结构不同,所以二者一定不是同系物;它们与氢气充分反应后分别生成乙醇和丙醇,所以与氢气加成的产物属于同系物,故B错误;
)的结构不同,所以二者一定不是同系物;它们与氢气充分反应后分别生成乙醇和丙醇,所以与氢气加成的产物属于同系物,故B错误;
C.麦芽糖和纤维二糖水解后都只得到葡萄糖,故C正确;
D.甲醛与氢氧化铜浊液的反应应在碱性条件下进行,加入氢氧化钠较少,故D错误。
答案选C。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_____。
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_________________。
②同学们在两烧杯中还观察到以下现象。其中,属于盛放Na2CO3的烧杯中出现的现象的是______(填字母序号)。
a.溶液温度下降 b.溶液温度升高 c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,__________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是__________。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象作出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—浓度较大,能与CaCl2发生反应______________(写离子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32—浓度很小,不能与CaCl2反应 |
实际实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为_______________________________。
【题目】贮氢合金![]() 可催化由CO、
可催化由CO、![]() 合成
合成![]() 等有机化工产品的反应。温度为TK时发生以下反应:
等有机化工产品的反应。温度为TK时发生以下反应:
①![]()
![]()
②![]()
![]()
③![]()
④![]()
(1)温度为TK时,催化由CO、![]() 合成
合成![]() 反应的热化学方程式为________。
反应的热化学方程式为________。
(2)已知温度为TK时![]() 的活化能为
的活化能为![]() ,则其逆反应的活化能为________
,则其逆反应的活化能为________![]() 。
。
(3)![]() 时,向一恒压密闭容器中充入等物质的量的
时,向一恒压密闭容器中充入等物质的量的![]() 和
和![]() 发生上述反应②
发生上述反应②![]() 已排除其他反应干扰
已排除其他反应干扰![]() ,测得
,测得![]() 物质的量分数随时间变化如下表所示:
物质的量分数随时间变化如下表所示:
时间 | 0 | 2 | 5 | 6 | 9 | 10 |
|
|
|
|
|
|
|
若初始投入CO为![]() ,恒压容器容积
,恒压容器容积![]() ,用
,用![]() 表示该反应
表示该反应![]() 分钟内的速率
分钟内的速率![]() ________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
(4)![]() 下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为
下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为![]() ,达到平衡转化率为
,达到平衡转化率为![]() ,则反应的平衡常数
,则反应的平衡常数![]() ________
________![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数,忽略其它反应
物质的量分数,忽略其它反应![]() 。
。
(5)某温度下,将![]() 与
与![]() 的混合气体充入容积为
的混合气体充入容积为![]() 的密闭容器中,在催化剂的作用下发生反应③。经过
的密闭容器中,在催化剂的作用下发生反应③。经过![]() 后,反应达到平衡,此时转移电子
后,反应达到平衡,此时转移电子![]() 。若保持体积不变,再充入
。若保持体积不变,再充入![]() 和
和![]() ,此时
,此时![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。下列不能说明该反应已达到平衡状态的是________。
。下列不能说明该反应已达到平衡状态的是________。
![]() 的质量不变
的质量不变 ![]() 混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
![]()
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
(6)已知![]() 、
、![]() 时水煤气变换中CO和
时水煤气变换中CO和![]() 分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的
分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等;已知
相等;已知![]() 时
时![]() 的
的![]() 。
。

![]() 时
时![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时
时![]() 随时间变化关系的曲线是________。
随时间变化关系的曲线是________。
【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
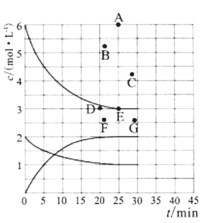
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。