题目内容
18.轧钢厂排出的废水主要含有盐酸,通常采用的处理方法是( )| A. | 中和法 | B. | 过滤法 | C. | 氧化还原法 | D. | 化学沉淀法 |
分析 废水主要含有盐酸,显酸性,可加碱性物质中和酸性,以此来解答.
解答 解:废水主要含有盐酸,显酸性,可发生中和反应降低酸性,为中和法,不能过滤、沉淀或发生氧化还原反应除去氢离子,
故选A.
点评 本题考查废水的处理,为高频考点,把握物质的性质、发生的反应、废水处理方法为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
8.下列说法不正确的是( )
| A. | 苯酚沾到手上,应立即用浓NaOH溶液清洗 | |
| B. | 酒精灯在桌上倾倒失火时,立即用湿布盖灭 | |
| C. | 点燃CO、CH4等可燃性气体前,必须检验气体的纯度 | |
| D. | 给试管里的液体加热时,液体体积一般不超过试管容积的$\frac{1}{3}$ |
9.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,2.24LO2、O3的混合气体含有NA个分子 | |
| B. | 28 g CO和N2混合气体含有NA个分子 | |
| C. | 标准状况下,4.48 L水含有的分子数等于0.2NA | |
| D. | 标准状况下,CO2与Na2O2反应生成2.24 L O2转移的电子数为0.4NA |
13.设 NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L 浓硫酸与足量铜加热充分反应,其中有 0.09NA 个 H2SO4 体现 了氧化性 | |
| B. | 将 5.6g 铁在 3.36LCl2 中点燃,二者一定能恰好完全反应 | |
| C. | 100mL 1mol/L 硫酸溶液中,有 0.1mol H2SO4分子 | |
| D. | 标准状况下,22.4 L CO2和 CO 混合气体中含有的碳原 子数约为 NA |
3. 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔:
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$ 乙炔$\stackrel{③}{→}$聚乙炔
写出反应②③的化学方程式②CaC2+2H2O=Ca(OH)2+C2H2↑、③nC2H2$\stackrel{一定条件}{→}$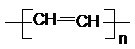 .
.
(2)试管B收集用的产品中,有能使酸性高锰酸钾溶液褪色的物质,其一氯化物有4种.并写出该物质与硝酸反应的化学方程式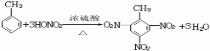 .
.
(3)锥形瓶C中观察到的现象棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8
(4)某有机物常温下为液体,与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,该有机物的结构简式可能为CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2.
 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$ 乙炔$\stackrel{③}{→}$聚乙炔
写出反应②③的化学方程式②CaC2+2H2O=Ca(OH)2+C2H2↑、③nC2H2$\stackrel{一定条件}{→}$
(2)试管B收集用的产品中,有能使酸性高锰酸钾溶液褪色的物质,其一氯化物有4种.并写出该物质与硝酸反应的化学方程式
 .
.(3)锥形瓶C中观察到的现象棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8
(4)某有机物常温下为液体,与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,该有机物的结构简式可能为CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2.
7.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 25℃时,1LpH=11的氨水中OH-为0.001NA | |
| B. | 标准状况下,2.24LSO3的氧原子数为0.3NA | |
| C. | 4.6g乙醇中含有的共价键数为0.7NA | |
| D. | 3.6gD2O所含质子数为2NA |
 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题: