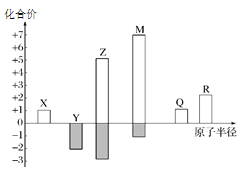
题目内容
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
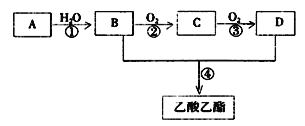
回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
【答案】羟基 羧基 加成反应 催化氧化反应 取代反应(酯化反应) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+C2H5OH
2CH3CHO+2H2O CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,所以A是乙烯。乙烯和水加成生成乙醇,所以B是乙醇。乙醇氧化为乙醛,乙醛进一步氧化为乙酸,乙酸和乙醇发生酯化反应生成乙酸乙酯。所以C是乙醛,D是乙酸。
(1)B为乙醇,官能团为羟基,D为乙酸,官能团为羧基。
(2)反应①是乙烯和水加成生成乙醇的反应,为加成反应,②是乙醇催化氧化生成乙醛的反应,反应类型为催化氧化反应,④为乙醇和乙酸发生酯化反应生成乙酸乙酯的反应,反应类型为酯化反应,酯化反应即为取代反应。
(3)反应①:CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
反应②:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
反应④:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O

【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
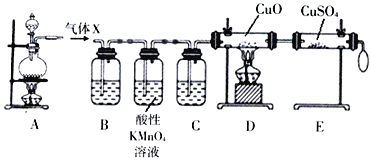
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
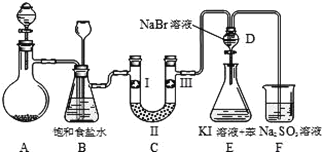
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01 mol·L-1,则溶液中CO32-物质的量浓度应 ≥ ______________。