题目内容
过氧化钙(CaO2)是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.实验室
可用钙盐制取CaO2·8H2O,再经脱水制得CaO2.CaO2·8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2.其制备过程如下: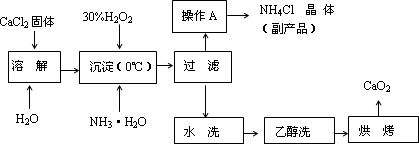
根据以上信息,回答下列问题:
(1)写出制取
CaO2·8H2O的化学方程式是________.(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是________.
(3)操作A的步骤为________.
(4)检验“水洗”已经洗净的方法是________.
(5)测定含杂质的产品中
CaO2含量的实验步骤是:(己知:①CaO2在酸性条件下将I-氧化为I2 ②I2+2S2O32-→2I-+S4O62- ③杂质不与I-反应)
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入适量2 mol/L的盐酸,充分反应.
第二步:向上述锥形瓶中加入几滴淀粉溶液.
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL.
①第三步反应完全时的现象为________.
②产品中CaO2的质量分数为________.(用字母表示)
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的
CaO2的质量分数偏高(测定过程中由操作产生的误差忽略不计),可能的原因是________.
答案:
解析:
解析:
|
(1)CaCl2+H2O2+2NH3·H2O+6H2O→CaO2·8H2O↓+2NH4Cl(2分) (2)冰水浴冷却(或将反应容器浸泡在冰水中) (3)向滤液中加入适量HCl,蒸发浓缩,冷却结晶,过滤,洗涤,干燥(3分) (4)取少许洗涤液,向其中加入稀硝酸酸化的硝酸银溶液,若不产生白色沉淀,则说明已经洗净(2分) (5)①溶液由蓝色变为无色,并在半分钟内不再变化 ② ③在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高(1分) |

练习册系列答案
相关题目
 (2分)
(2分)

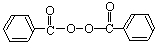 )和过氧化钙(CaO2)。下列关于“面粉增白剂”的说法不正确的是(
)
)和过氧化钙(CaO2)。下列关于“面粉增白剂”的说法不正确的是(
)