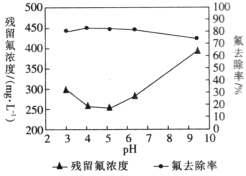
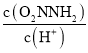题目内容
【题目】A~J是中学化学中常见的物质,它们之间的转化关系如图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕固体,H的焰色呈黄色。

请回答下列问题:
(1)A物质的化学式为________,H物质的名称为______________________。
(2)G![]() J的实验现象是_________________;化学方程式为___________________。
J的实验现象是_________________;化学方程式为___________________。
(3)D与C高温下反应的化学方程式为:________________。
(4)D物质与盐酸恰好反应的离子方程式为__________,所得溶液的颜色为_______________________。
【答案】Al2O3 偏铝酸钠 白色沉淀迅速变为灰绿色,最终变成红褐色沉淀 4Fe(OH)2+O2+2H2O═4Fe(OH)3 Fe2O3+2Al![]() 2Fe+ Al2O3 Fe2O3+6H+═2Fe3++3H2O 浅黄色
2Fe+ Al2O3 Fe2O3+6H+═2Fe3++3H2O 浅黄色
【解析】
D是一种红棕色固体,应为Fe2O3,可与C反应,生成物A既可与盐酸反应,又可与NaOH反应,由转化关系可知C为Al,A为Al2O3,E为Fe,B为O2,H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,结合物质的性质以及题目要求可解答该题.
(1)由上述分析可知A为Al2O3,H的名称为偏铝酸钠,
故答案为:Al2O3;偏铝酸钠;
(2)G→J的实验现象是白色沉淀迅速变为灰绿色,最终变成红褐色沉淀,化学方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色,最终变成红褐色沉淀;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)D与C高温下反应的化学方程式为Fe2O3+2Al![]() 2Fe+ Al2O3,
2Fe+ Al2O3,
故答案为:Fe2O3+2Al![]() 2Fe+ Al2O3;
2Fe+ Al2O3;
(4)D物质与盐酸恰好反应的离子方程式为Fe2O3+6H+═2Fe3++3H2O,生成铁离子,溶液颜色为浅黄色,
故答案为:Fe2O3+6H+═2Fe3++3H2O;浅黄色。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案