题目内容
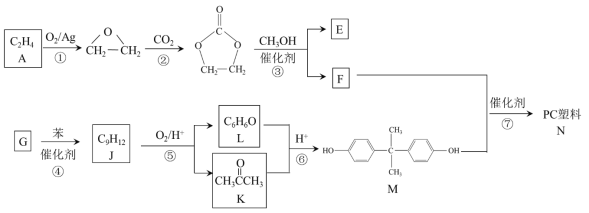
【题目】分析如图,按要求写出有关反应方程式:

(1)铁棒上的电极反应式为:___;
(2)碳棒上的电极反应式为:___;
(3)溶液中发生反应的化学方程:___。
【答案】Fe-2e-=Fe2+ 2H2O+O2+4e-=4OH- 2Fe+2H2O+O2=2Fe(OH)2、4Fe(OH) 2+2H2O+O2=4Fe(OH)3
【解析】
由碳棒、铁片和氯化钠溶液组成的原电池中,Fe为负极,负极上Fe失电子生成亚铁离子,碳棒为正极,氧气在正极上得电子生成氢氧根离子,亚铁离子与氢氧根离子结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,据此分析。
由碳棒、铁片和氯化钠溶液组成的原电池中,Fe为负极,负极上Fe失电子生成亚铁离子,碳棒为正极,氧气在正极上得电子生成氢氧根离子,亚铁离子与氢氧根离子结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,
(1)由以上分析可知,Fe作负极,负极上Fe失电子生成亚铁离子,电极反应式为:Fe-2e-=Fe2+;
故答案为:Fe-2e-=Fe2+;
(2)碳棒为正极,氧气在正极上得电子生成氢氧根离子,碳棒上的电极反应式为:2H2O+O2+4e-=4OH-;
故答案为:2H2O+O2+4e-=4OH-;
(3)负极生成的亚铁离子与正极生成的氢氧根离子结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,则溶液中发生的反应为2Fe+2H2O+O2=2Fe(OH)2、4Fe(OH) 2+2H2O+O2=4Fe(OH)3;
故答案为:2Fe+2H2O+O2=2Fe(OH)2、4Fe(OH) 2+2H2O+O2=4Fe(OH)3。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O