题目内容
17.2L甲醛气体与x L氧气混合点燃,甲醛充分反应后,生成的混合气体的体积为a L(气体的体积均在120°C,101kPa时测定),将a L混合气体通过足量的碱石灰后,测得剩余气体的体积为b L,若a-b=3.5,则x的值为1.5.分析 被足量碱石灰吸收的是H2O和CO2,因此反应生成的H2O和CO2为3.5L,由于丙烷完全反应:CH2O+O2$\stackrel{点燃}{→}$CO2+H2O,如果充分燃烧,2L甲醛可以生成4L气体,大于3.5L,说明甲醛是不完全燃烧,生成物中有CO,由原子守恒可知2L甲醛完全反应生成的气体(120℃)一定共是2L水蒸气、2L碳的氧化物(CO和CO2),计算CO的体积,根据氧原子守恒计算氧气的体积.
解答 解:被足量碱石灰吸收的是H2O和CO2,因此反应生成的H2O和CO2为3.5L,由于丙烷完全反应:CH2O+O2$\stackrel{点燃}{→}$CO2+H2O,如果充分燃烧,2L甲醛可以生成4L气体,大于3.5L,说明甲醛是不完全燃烧,生成物中有CO,由原子守恒可知2L甲醛完全反应生成的气体(120℃)一定共是2L水蒸气、2L碳的氧化物(CO和CO2),因此反应后生成气体体积为4L,即:a=4,
根据a-b=3.5可知:b=0.5,即CO为0.5L,则CO2为:2L-0.5L=1.5L,
根据氧元素守恒,x=$\frac{2+2×1.5-2}{2}$=1.5,
故答案为:1.5.
点评 本题考查混合物的计算,题目难度中等,判断甲醛不完全燃烧生成二氧化碳、一氧化碳是关键,注意掌握质量守恒定律在化学计算中的应用.

练习册系列答案
相关题目
7.在烷烃分子中的基团:-CH3,-CH2-, ,
, 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
 ,
, 中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )
中的碳原子分别称为伯,仲,叔,季碳原子,数目分别用n1,n2,n3,n4来表示.若烷烃分子中氢原子数n0,则不同烷烃分子中各原子数的关系不正确的是( )| A. | n0=3n1+2n2+n3 | B. | n0=2(n1+n2+n3+n4)+2 | ||
| C. | n1=n3+2n4+2 | D. | n1=n3+2n2+2 |
8.化学与我们的生活密切相关,但我们在改善自己生活环境的同时也破坏了自然,旨在限制温室气体排放量、抵制全球范围内气候持续变暖的《京都议定书》于2005年2月16日正式生效.我国二氧化碳的排放量位居世界第二,下列减少二氧化碳这种温室气体排放的措施不切实际的是( )
| A. | 积极开发氢能源 | B. | 充分利用太阳能 | C. | 不使用化石燃料 | D. | 积极开发核能源 |
5. 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时化学能转化为电能 | |
| B. | 该电池的总反应为:2H2+O2═2H2O | |
| C. | 该电池中电极b是正极 | |
| D. | 外电路中电子由电极b通过导线流向电极a |
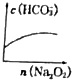
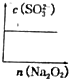
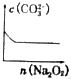
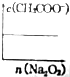
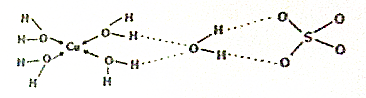
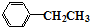 $\stackrel{KMnO_{4}溶液}{→}$
$\stackrel{KMnO_{4}溶液}{→}$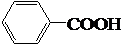
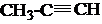 +Br2→CH3-CBr=CHBr
+Br2→CH3-CBr=CHBr $→_{Cl_{2}}^{光照}$
$→_{Cl_{2}}^{光照}$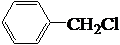 (一卤代物)
(一卤代物)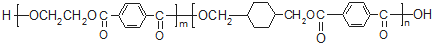
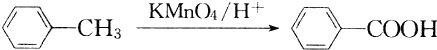
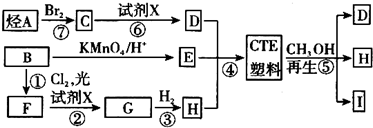
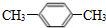 ,I的结构简式为
,I的结构简式为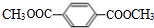 .
.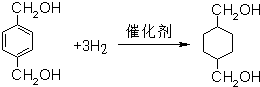 .
.