题目内容
18.如图是某煤发电厂处理废气的原理示意图,下列说法正确的是( )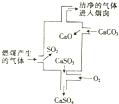
| A. | 使用此废气处理工艺不能减少SO2的排放 | |
| B. | 该过程发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用NaOH溶液检验废气处理是否达标 |
分析 A.根据废气处理工艺流程可知,该过程中减少了二氧化硫的排放;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是复分解反应和氧化还原反应;
C.反应物为碳酸钙、氧气和二氧化硫,产物为硫酸钙和二氧化碳;
D.氢氧化钠与二氧化硫的反应没有明显现象,无法检验二氧化硫.
解答 解:A.根据图示可知,使用此废气处理工艺能够大大减少SO2的排放,故A错误;
B.碳酸钙受热生成氧化钙和二氧化碳的反应属于分解反应;二氧化硫与石灰水反应生成CaSO3和CaSO4是中和反应、化合反应,氧化还原反应,但没有涉及置换反应,故B错误;
C.整个过程中,二氧化硫与碳酸钙和氧气反应生成了硫酸钙和二氧化碳,化学反应式可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2,故C正确;
D.二氧化硫具有还原性,可用酸性高锰酸钾溶液检验废气处理是否达标,而二氧化硫与氢氧化钠溶液的反应没有明显现象,无法检验二氧化硫,故D错误;
故选C.
点评 本题考查二氧化硫气体的污染和治理方法,题目难度中等,根据图示工业流程明确反应原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
8.与苯环上的碳氢键相比,甲苯中的侧链甲基或苯酚中的羟基对苯环上的碳氢键的化学活泼性具有较大影响,下列关于甲苯或苯酚的实验事实中,能说明侧链或羟基对苯环有影响的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯能与浓硝酸、浓硫酸反应生成TNT | |
| C. | 苯酚能与FeCl3溶液发生显色反应 | |
| D. | 苯酚具有酸性,能与碳酸钠溶液发生反应 |
9.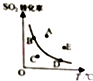 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
 对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
对于可逆反应:2SO2(g)+O2(g)?2SO2(g)△H<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )| A. | A点 | B. | B、D两点 | C. | C点 | D. | A、E两点 |
13. 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
 英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )
英国科学家近日研发出一种名为NOTT-202a的新型多孔材料,空气中其他气体可自由通过这些空洞,但CO2会被截留.该材料的分子结构单元是以铟原子为中心,周围是以各种有机分子链条编织的“笼子”,整体上看呈现多孔特征,有些类似自然界中的蜂窝结构,下列有关说法正确的是( )| A. | 该材料完全由金属元素构成 | |
| B. | 该材料能捕集CO2,是因为该材料可以选择性吸收CO2 | |
| C. | 该材料捕集11.2LCO2后,增重22g | |
| D. | 可利用该材料将空气中的CO2,完全捕集,从而控制温室效应 |
3.如图装置的电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
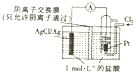

| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
10.下列关于同分异构体的说法中正确的是( )
| A. | 相对分子质量相同,结构不同的化合物互为同分异构体 | |
| B. | 同分异构体间的相互转化不存在能量的变化 | |
| C. | C4H10的一氯代物共2种结构 | |
| D. | 甲苯( )苯环上的氢原子被一个氯原子取代后的产物共有3种 )苯环上的氢原子被一个氯原子取代后的产物共有3种 |
7.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定条件下,将1molN2和3molH2H混合,充分反应后转移电子数为6NA | |
| B. | 常温下,5.6gFe与足量浓硝酸作用转移电子数一定为0.3NA | |
| C. | 65gZn与一定量的浓硫酸反应至完全溶解,转移电子数一定为2NA | |
| D. | 6.4g由S2、S4、S8组成的混合物中含有硫原子的数目为0.1NA |
8.甲烷作为一种新能源在化学领域应用广泛,用作燃料电池的电极反应为:负极:CH4+10OH--8e-═CO32-+7H2O,正极:2O2+4H2O+8e-═8OH-,该电池工作时,下列叙述正确的是( )
| A. | 氧气发生氧化反应 | |
| B. | 每转移2mol电子,电池内增加2molH2O | |
| C. | C正极附近c(H+)增大 | |
| D. | 负极附近溶液的pH值降低 |
 现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题:
现有X、Y、Z、R、T五种短周期主族元素,R原子电子数是电子层数的3倍:Y与X能形成X2Y、X2Y2型共价化合物,Z与T形成的Z2T型离子化合物.五种元素的原子半径与原子序数的关系如图所示.回答下列问题: .
.