题目内容
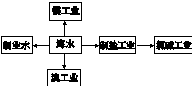
海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下:

(1)请写出一种海水淡化的方法:______.
(2)步骤Ⅰ获得Br2 的离子方程式为______;
(3)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的.其反应方程式为Br2+SO2+2H2O=H2SO4+2HBr,在该反应中,氧化剂是______(填化学式).若反应中生成 2mol HBr,则消耗______mol SO2.
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的顺序是______.
解:(1)淡化海水的方法有:蒸馏法、电渗析法、离子交换法等,故答案为:蒸馏法、电渗析法、离子交换法等;
(2)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(3)因Br2中Br的化合价从0价降低为-1价,Br2是氧化剂,
由Br2 +SO2 +2H2O=H2SO4 +2HBr
1mol 1mol 1mol 2mol
所以消耗1molSO2,生成 2molHBr,故答案为:Br2;1;
(4)Cl2+2Br-=Br2+2Cl-,因氧化性:氧化剂大于氧化产物,所以氧化性:Cl2>Br2;
Br2+SO2 +2H2O=H2SO4 +2HBr,因氧化性:氧化剂大于还原剂,所以氧化性:Br2>SO2;
故答案为:Cl2>Br2>SO2.
分析:(1)目前淡化海水的方法有:蒸馏法、电渗析法、离子交换法等,其中最常用的是蒸馏法;
(2)氯气具有氧化性,能氧化溴离子生成单质溴;
(3)氧化剂的化合价降低;根据方程式Br2+SO2+2H2O=H2SO4+2HBr计算;
(4)氧化还原方程式中:氧化性:氧化剂大于氧化产物,氧化剂大于还原剂.
点评:本题考查较为综合,涉及海水的淡化,氧化还原反应等知识,侧重于考查学生综合运用化学知识的能力,题目难度不大,注意把握氧化性、还原性的比较方法.
(2)氯气具有氧化性,能氧化溴离子生成单质溴:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(3)因Br2中Br的化合价从0价降低为-1价,Br2是氧化剂,
由Br2 +SO2 +2H2O=H2SO4 +2HBr
1mol 1mol 1mol 2mol
所以消耗1molSO2,生成 2molHBr,故答案为:Br2;1;
(4)Cl2+2Br-=Br2+2Cl-,因氧化性:氧化剂大于氧化产物,所以氧化性:Cl2>Br2;
Br2+SO2 +2H2O=H2SO4 +2HBr,因氧化性:氧化剂大于还原剂,所以氧化性:Br2>SO2;
故答案为:Cl2>Br2>SO2.
分析:(1)目前淡化海水的方法有:蒸馏法、电渗析法、离子交换法等,其中最常用的是蒸馏法;
(2)氯气具有氧化性,能氧化溴离子生成单质溴;
(3)氧化剂的化合价降低;根据方程式Br2+SO2+2H2O=H2SO4+2HBr计算;
(4)氧化还原方程式中:氧化性:氧化剂大于氧化产物,氧化剂大于还原剂.
点评:本题考查较为综合,涉及海水的淡化,氧化还原反应等知识,侧重于考查学生综合运用化学知识的能力,题目难度不大,注意把握氧化性、还原性的比较方法.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
海水是巨大的资源宝库,下列关于海水综合利用的说法错误的是( )

| A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等 | B、海水制盐、发展氯碱工业都是发生物理变化 | C、海水提溴过程中先通入Cl2将溴离子氧化为溴单质 | D、工业上用电解熔融MgCl2的方法制取金属镁 |




