题目内容
56gFe粉投入到800ml稀HNO3中,两者恰好完全反应放出NO(无其它还原产物),溶液增重32g,则稀HNO3溶液的物质的量浓度为
- A.4.75mol/L
- B.4.0mol/L
- C.3.8mol/L
- D.3.5mol/L
B
分析:可能发生的反应有:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据相关物理量列方程解答.
解答:n(Fe)= =1mol,
=1mol,
可能发生的反应有:①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
设有xmolFe参加①反应,有ymolFe参加②反应.
则Fe+4HNO3=Fe(NO3)3+NO↑+2H2O△m
1mol 26g
xmol 26xg
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O△m
3mol 108g
ymol ×108yg
×108yg
则
解之得:x=0.4,y=0.6
则消耗的硝酸共为:0.4mol×4+0.6mol×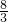 =3.2mol,
=3.2mol,
则c(HNO3)= =4.0mol/L,
=4.0mol/L,
故选B.
点评:本题考查化学方程式的计算,题目难度中等,本题注意根据质量的变化结合反应的方程式计算,注意从质量守恒的角度分析.
分析:可能发生的反应有:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据相关物理量列方程解答.
解答:n(Fe)=
 =1mol,
=1mol,可能发生的反应有:①Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,②3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
设有xmolFe参加①反应,有ymolFe参加②反应.
则Fe+4HNO3=Fe(NO3)3+NO↑+2H2O△m
1mol 26g
xmol 26xg
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O△m
3mol 108g
ymol
 ×108yg
×108yg则

解之得:x=0.4,y=0.6
则消耗的硝酸共为:0.4mol×4+0.6mol×
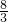 =3.2mol,
=3.2mol,则c(HNO3)=
 =4.0mol/L,
=4.0mol/L,故选B.
点评:本题考查化学方程式的计算,题目难度中等,本题注意根据质量的变化结合反应的方程式计算,注意从质量守恒的角度分析.

练习册系列答案
相关题目
 3Fe+4CO2的中,______是氧化剂,______是还原剂,______元素被氧化.
3Fe+4CO2的中,______是氧化剂,______是还原剂,______元素被氧化.