题目内容
按下列要求写出由第二周期非金属元素组成的中性分子的相关内容:
(1)平面三角形分子:分子式 ,中心原子杂化方式是 .
(2)三角锥形分子:分子式 ,VSEPR模型为 .
(3)正四面体形分子:结构式 ,中心原子杂化方式是 .
(4)互为等电子体的两对物质的分子式:N2和 ,CO2和 .
(1)平面三角形分子:分子式
(2)三角锥形分子:分子式
(3)正四面体形分子:结构式
(4)互为等电子体的两对物质的分子式:N2和
考点:判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)第二周期非金属元素组成的中性分子,如果呈平面三角形结构,中心原子可以有3对电子对,且没有孤电子对,中心原子杂化方式为SP2;
(2)如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4;
(3)如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有CF4;
(4)原子数相同、电子数也相同的物质称为等电子体,可以运用等量异质替换寻找等电子体.
(2)如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4;
(3)如果该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,该类型分子有CF4;
(4)原子数相同、电子数也相同的物质称为等电子体,可以运用等量异质替换寻找等电子体.
解答:
解:(1)由第二周期非金属元素构成的中性分子,第二周期元素为中心原子,通过sp2杂化形成中性分子,是平面形分子,该类型分子有BF3,中心原子B价层电子对数=3+
=3,杂化方式为sp2杂化,故答案为:BF3;SP2;
(2)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4,则该分子是NF3,中心原子N价层孤电子对数=3+
=4,VSEPR模型为四面体型,故答案为:NF3;四面体型;
(3)该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,杂化方式为SP3,该类型分子有CF4,故答案为:CF4;SP3;
(4)将N原子电子数加1得O原子,将N原子电子数减1得C原子,N2的等电子体为CO;将C原子电子数加1得N原子,将O原子电子数减1得N原子,CO2的等电子体为N2O,故答案为:CO;N2O.
| 3-1×3 |
| 2 |
(2)第二周期非金属元素组成的中性分子,如果呈三角锥型结构说明中心原子含有一个孤电子对,且价电子对数是4,则该分子是NF3,中心原子N价层孤电子对数=3+
| 5-1×3 |
| 2 |
(3)该分子为正四面体结构,则该分子的价层电子对个数是4且不含孤电子对,杂化方式为SP3,该类型分子有CF4,故答案为:CF4;SP3;
(4)将N原子电子数加1得O原子,将N原子电子数减1得C原子,N2的等电子体为CO;将C原子电子数加1得N原子,将O原子电子数减1得N原子,CO2的等电子体为N2O,故答案为:CO;N2O.
点评:本题紧扣教材,难易适中,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和创新思维能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯气溶于水:Cl2+H20═2H++C1-+C10- |
| B、硫酸铝溶液中加入足量氨水:Al3++40H-═[Al(OH)4]- |
| C、大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
| D、碳酸钠溶液水解的离子方程式:CO32-+2H2O?H2CO3+2OH- |
现有一种碳酸钠晶体(Na2CO3?nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.学生测定结果n值偏小,其可能的原因为( )
| A、温度过高致少量碳酸钠分解了 |
| B、碳酸钠晶体样品已有少量风化 |
| C、样品加热后放在干燥器中进行冷却 |
| D、加热过程中有少量晶体溅出 |
1.52g铜镁合金完全溶解于足量的稀硝酸中,充分反应后,加入足量的NaOH溶液,经过过滤、洗涤、干燥后称得固体质量为2.54g,问生成的气体在标准状况下的体积 L,镁的物质的量是 ,铜的物质的量是 .
设阿伏加德罗常数的值为NA,下列说法正确的是( )
| A、18g冰晶体中含有的氢键数为4NA |
| B、30g SiO2晶体中含Si-O键数为NA |
| C、78g Na2O2晶体中含有阴阳离子总数为4NA |
| D、62g 白磷晶体中含P-P键数为3NA |
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的是( )

| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、它是芳香族有机物 |
| D、该物质是高分子化合物 |
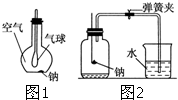 (1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到
(1)如图1所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到