题目内容
【题目】化学中存在许多平衡,如化学平衡、电离平衡、水解平衡、溶解平衡等等,对应的有化学平衡常数、电离平衡常数等。按要求回答下列问题:
(1)反应H2(g)+I2(g)2HI(g)的平衡常数为K1;反应HI(g)![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
(2)汽车净化原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。

(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是___。
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为___,少量CO2与NaHS反应的离子方程式为___。
(5)25℃时,向0.01molL-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为___;当Mg2+完全沉淀时,溶液的pH为___(忽略溶液体积变化,已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,已知lg2.4=0.4,lg7.7=0.9。
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+Fe3++3H2O的平衡常数K=___。
【答案】K1=![]() B AC c(CH3COONa)>c(NaHS)>c(Na2CO3) HS-+H2O+CO2=H2S+HCO3- 9.6 11.1 2.79×103
B AC c(CH3COONa)>c(NaHS)>c(Na2CO3) HS-+H2O+CO2=H2S+HCO3- 9.6 11.1 2.79×103
【解析】
(1)根据化学平衡常数表达式,列出各反应的化学的平衡常数;
(2)应注意容器为绝热,然后进行分析;
(3)应注意H2B的第一步电离是完全电离,进行分析;
(4)利用“越弱越水解”以及电离平衡常数大的制取电离平衡常数小的;
(5)利用溶度积进行计算;
(6)利用化学平衡常数进行分析;
(1)反应![]() 的平衡常数
的平衡常数![]() ,则相同温度下,反应
,则相同温度下,反应![]() 的平衡常数为
的平衡常数为![]() ,故反应
,故反应![]() 的平衡常数
的平衡常数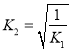 ,故K
,故K![]() ;
;
答案为:![]() ;
;
(2)A. 到达平衡后正、逆速率相等,不再变化,![]() 时刻
时刻![]() 最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B. 化学平衡常数是温度的函数,一定温度下,平衡常数不变,说明温度不变,反应在绝热容器中进行,说明正向的放热与逆向吸热相抵,速率相等,达到平衡状态,故B正确;
C. ![]() 时刻后二氧化碳、CO的物质的量发生变化,
时刻后二氧化碳、CO的物质的量发生变化,![]() 时刻未到达平衡状态,故C错误;
时刻未到达平衡状态,故C错误;
D. 图中![]() 后NO的质量分数随时间的变化而变化,不能判断反应达到平衡状态,故D错误;
后NO的质量分数随时间的变化而变化,不能判断反应达到平衡状态,故D错误;
答案为:B;
(3)在![]() 中存在水解平衡:
中存在水解平衡:![]()
![]()
![]() ,
,![]() 不会进一步水解,所以溶液中没有
不会进一步水解,所以溶液中没有![]() 分子,
分子,
A. 根据物料守恒得![]() ,故A正确;
,故A正确;
B. ![]() 不会进一步水解,所以溶液中没有
不会进一步水解,所以溶液中没有![]() 分子,故B错误;
分子,故B错误;
C. 根据质子守恒得![]() ,故C正确;
,故C正确;
D. 根据电荷守恒得![]() ,故D错误;
,故D错误;
答案为:AC;
(4)![]() 、
、![]() 、NaHS是强碱弱酸盐,相同物质的量浓度的
、NaHS是强碱弱酸盐,相同物质的量浓度的![]() 、
、![]() 、NaHS溶液对应的酸越弱水解程越大,pH值越大,所以相同浓度的三种溶液,pH大小关系为:
、NaHS溶液对应的酸越弱水解程越大,pH值越大,所以相同浓度的三种溶液,pH大小关系为:![]() ,pH相同的
,pH相同的![]() 、
、![]() 、NaHS溶液物质的量浓度由大到小的顺序是
、NaHS溶液物质的量浓度由大到小的顺序是![]() ;向NaHS溶液中通入少量
;向NaHS溶液中通入少量![]() ,由于酸性:
,由于酸性:![]() ,故反应生成
,故反应生成![]() 和碳酸氢钠,不能生成二氧化碳,故反应的离子方程式为
和碳酸氢钠,不能生成二氧化碳,故反应的离子方程式为![]() ;
;
答案为:![]() ;
;![]() ;
;
(5)已知![]() ,逐滴加入NaOH溶液,当刚好出现沉淀时,
,逐滴加入NaOH溶液,当刚好出现沉淀时,![]() ,故
,故![]() ,
,![]() ,故
,故![]() ,即当
,即当![]() 时,氢氧化镁开始沉淀;一般认为:溶液中离子浓度小于
时,氢氧化镁开始沉淀;一般认为:溶液中离子浓度小于![]() 时沉淀完全,故镁离子完全沉淀时有:
时沉淀完全,故镁离子完全沉淀时有:![]() ,故
,故![]() ,
,![]() ,故
,故![]() ,即当
,即当![]() 时,氢氧化镁沉淀完全;
时,氢氧化镁沉淀完全;
答案为:![]() ;
;![]() ;
;
(6)已知![]() 时,
时,![]() ,
,![]() 的平衡常数
的平衡常数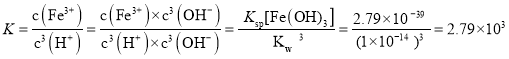 ;
;
答案为:![]() 。
。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案