题目内容
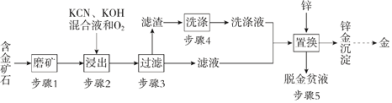
【题目】用AG表示溶液酸度:![]() 。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是
。在室温下,用 0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,滴定结果如图所示。下列分析正确的是

A. 0.1molL-1的CH3 COOH溶液的pH=3.4
B. A点加入的NaOH溶液的体积为20.00mL
C. 滴定过程中,c(CH3COO-)/c(H+)逐渐减小
D. B点溶液中可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+)
【答案】D
【解析】
室温下,用0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,发生的反应为NaOH+CH3 COOH=CH3 COONa+H2O,化学计量点时恰好生成CH3 COONa,水解使溶液碱性,此时消耗NaOH的体积为20.00mL,结合图象和溶液中的守恒思想分析判断。
室温下,用0.1molL-1的NaOH溶液滴定20.00mL 0.1molL-1的CH3 COOH溶液,发生的反应为NaOH+CH3 COOH=CH3 COONa+H2O,化学计量点时恰好生成CH3 COONa,水解使溶液碱性,此时消耗NaOH的体积为20.00mL。
A、滴定起始时,溶液中仅存在醋酸,此时,![]() ,则
,则![]() ,由于Kw=c(H+)c(OH-),则溶液中c(H+)=10-3.3mol/L,因此0.1molL-1的醋酸pH=3.3,选项A错误;
,由于Kw=c(H+)c(OH-),则溶液中c(H+)=10-3.3mol/L,因此0.1molL-1的醋酸pH=3.3,选项A错误;
B、A点时AG=0,c(H+)=c(OH-),加入的NaOH溶液的体积小于20.00mL,若等于20.00mL则溶液应呈碱性AG<0,选项B错误;
C、滴定过程中,发生反应NaOH+CH3 COOH=CH3 COONa+H2O,CH3COO-增大,c(H+)减小,故c(CH3COO-)/c(H+)逐渐增大,选项C错误;
D、B点溶液若完全中和得到醋酸钠,溶液呈碱性,可能存在c(Na+)>c(CH3COO-)> c(OH-)>c(H+),选项D正确。
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g) ![]() C3H6(g)+H2(g) ΔH。请回答下列相关问题。
C3H6(g)+H2(g) ΔH。请回答下列相关问题。
(1)下表为部分键能数据,据此可算出△H=_________kJ/mol。
化学键 | C—C | C=C | C—H | H—H |
键能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定温度下,向2L的密闭容器中充入2molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率v(H2)=__________,C3H8的平衡转化率为_________。
②下列情况能说明该反应达到平衡状态的是___________。
A.混合气体的平均分子量保持不变
B. C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D. C3H8的分解速率与C3H6的消耗速率相等
(3)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1______p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是__________。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是___________________。