题目内容
在碱性溶液中能大量共存且为无色透明的溶液是( )
| A、K+、Cl-、MnO4-、SO42- |
| B、Na+、Cu2+、NO3-、CO32- |
| C、Na+、NO3-、SO42-、CO32- |
| D、Na+、Mg2+、SO42-、Cl- |
考点:离子共存问题
专题:离子反应专题
分析:某强碱性溶液中,含大量的OH-,根据离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应等,离子大量共存,并结合离子的颜色来解答.
解答:
解:A.该组离子之间不反应,可大量共存,但MnO4-为紫色,与无色不符,故A不选;
B.Cu2+、CO32-结合生成沉淀,不能大量共存,且Cu2+为蓝色,故B不选;
C.该组离子碱性条件下不反应,能大量共存,故C选;
D.Mg2+、OH-结合生成沉淀,不能大量共存,故D不选;
故选C.
B.Cu2+、CO32-结合生成沉淀,不能大量共存,且Cu2+为蓝色,故B不选;
C.该组离子碱性条件下不反应,能大量共存,故C选;
D.Mg2+、OH-结合生成沉淀,不能大量共存,故D不选;
故选C.
点评:本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意归纳常见离子的颜色,题目难度不大.

练习册系列答案
相关题目
以下各离子方程式所对应的化学反应方程式只能有一个的是( )
| A、H++OH-═H2O | ||
| B、CaCO3+2H+═Ca2++H2O+CO2↑ | ||
C、Cu2++S
| ||
| D、2Fe3++Cu═2Fe2++Cu2+ |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、△H<0,△S<0的反应在任何温度下自发进行 |
| C、同一种物质不同状态时熵值大小为S(g)<S(l)<S(s) |
| D、反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.3mol/L NaCl溶液含离子总数为0.6NA |
| B、常温常压下,18g H2O中含有的电子数总数为10NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、1L 2 mol/L Na2CO3溶液中含有的CO32-数目为4NA |
下列叙述中,正确的是( )
| A、一个基态多电子的原子中,可以有运动状态完全相同的电子 |
| B、元素原子的最外层电子数等于元素的最高正价 |
| C、凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体 |
| D、电子构型为[Ar]3d54s2的元素是过渡元素 |
NA为阿伏加德罗常数,下列说法中正确的是( )
| A、标准状况下,22.4LH2O所含有原子数为3NA |
| B、1mol OH-中含电子数目为9NA |
| C、标准状况下,11.2LN2和O2的混合气体所含的原子数为NA |
| D、1mol/L MgSO4溶液中所含SO42-数目为NA |
下列各组溶液中离子,能在溶液中大量共存的是( )
| A、H+、Ca2+、NO3-、CO32- |
| B、K+、Na+、Cl-、NO3- |
| C、Ag+、Na+、Cl-、K+ |
| D、NH4+、K+、NO3-、SO42- |
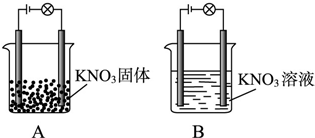 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是( )
| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |