题目内容
5.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.一定条件下,现有容积相同且恒容的密闭容器甲与乙:①向甲中通入1mol N2和3mol H2,达到平衡时放出热量Q1kJ;②向乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量Q2 kJ.则下列关系式正确的是( )| A. | Q1=2Q2=92.4 | B. | 92.4=Q1<2Q2 | C. | 92.4>Ql>2Q2 | D. | Q1=2Q2<92.4 |
分析 反应为可逆反应,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1<Q,甲与乙相比较,甲相当于在乙的基础上增大压强,平衡向正反应方向移动,则甲转化率大于乙,以此解答该题.
解答 解:反应为可逆反应,向密闭容器甲中通入1molN2和3molH2,达平衡时放出热量 Q1<92.4,甲与乙相比较,甲相当于在乙的基础上增大压强,平衡向正反应方向移动,则甲转化率大于乙,如转化率相等,则Q1=2Q2,而转化率越大,则反应的热量越多,则Q1>2Q2,所以2Q2<Q1<92.4;
故选:C.
点评 本题综合考查化学平衡移动问题,为高考常见题型,侧重于考查学生的分析能力,本题可从压强对平衡移动影响的角度分析,难度中等.

练习册系列答案
相关题目
10.可与人体血液中的物质结合导致中毒的空气污染物是( )
| A. | NO | B. | N2 | C. | CO2 | D. | CO |
11.下列说法正确的是( )
| A. | SO2与Na2SO3或NaHCO3溶液能发生反应 | |
| B. | SO2和CO2分别通入BaCl2和Ba(NO3)2溶液中都不产生沉淀 | |
| C. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| D. | SO2和O2混合加热,可生成三氧化硫 |
17.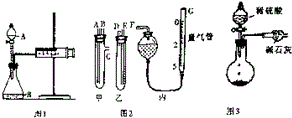 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
(1)甲同学用图1所示装置,把Ng的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积,实验开始时检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气.
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛有稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于甲、乙仪器中(填仪器编号);G管可用化学实验室里的一种常用仪器来代替,你认为这种仪器的名称是碱式滴定管;仪器甲、乙、丙接口的连接方式如下:A连接D,B连接E,C连接F(填写各接口的编号).
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,使测定结果可能偏小的主要原因可能是装置中的CO2没有全部被碱石灰吸收;(上述偏大、偏小的原因各写一条)
(4)某天然碱可看作向CO2和NaOH的反应后的产物所组成,称取天碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30毫升,产生CO2的体积(标准状况)如下表:
取3.28g天然碱样品于300℃加热至分解完全(300℃Na2CO3不分解),产生CO2224mL(标准状况)和一定量的水,则该天然碱样品的化学式为Na2CO3•2NaHO3•3H2O.
 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.(1)甲同学用图1所示装置,把Ng的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积,实验开始时检查该装置气密性的方法是关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气.
(2)乙同学用图2代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛有稀硫酸的试管,发生反应,放出气体,则Na2CO3、NaCl的固体混合物和稀硫酸应分别置于甲、乙仪器中(填仪器编号);G管可用化学实验室里的一种常用仪器来代替,你认为这种仪器的名称是碱式滴定管;仪器甲、乙、丙接口的连接方式如下:A连接D,B连接E,C连接F(填写各接口的编号).
(3)丙同学用图3装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因CO2气体中混有水蒸气或空气中的CO2和水蒸气进入干燥管中,使测定结果可能偏小的主要原因可能是装置中的CO2没有全部被碱石灰吸收;(上述偏大、偏小的原因各写一条)
(4)某天然碱可看作向CO2和NaOH的反应后的产物所组成,称取天碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30毫升,产生CO2的体积(标准状况)如下表:
| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
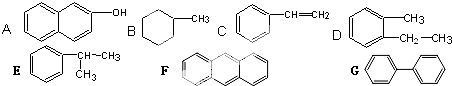
 ,
, (或
(或 ).
).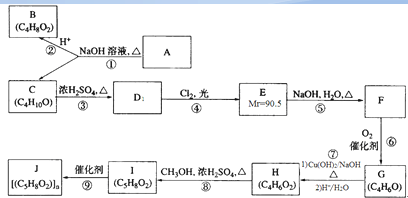
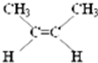 、CH2=CHCH2CH3;
、CH2=CHCH2CH3;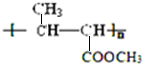 ;
;