题目内容
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:

(1)NiC2O4·2H2O中C的化合价是___。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为___。
(2)“滤渣Ⅰ”的主要成分是___。
(3)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是___。
(4)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。
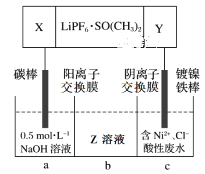
①电极X的反应材料是___(填化学式);中间隔室b可以得到的主要物质Z是___(填化学式)。
②电解总反应的离子方程式为___。
已知F=96500C/mol,若电池工作tmin,维持电流强度为I A,理论回收Ni___g(写出计算表达式即可)。
【答案】+3 废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等 SiO2和CaSO4 2NiC2O4![]() Ni2O3+3CO↑+CO2↑ FeS NaCl 4OH-+2Ni2+
Ni2O3+3CO↑+CO2↑ FeS NaCl 4OH-+2Ni2+![]() O2↑+2Ni+2H2O
O2↑+2Ni+2H2O ![]()
【解析】
制备草酸镍晶体(NiC2O4·2H2O)的流程:废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)加入硫酸溶解得到含有Ni2+、Zn2+、Fe2+、Ca2+的酸性溶液,部分Ca2+与SO42-结合得到微溶物CaSO4,SiO2不溶于酸,过滤,滤渣I为SiO2和CaSO4,向滤液中加入NaClO溶液氧化Fe2+为Fe3+,同时将其沉淀为Fe(OH)3,过滤,滤渣II为Fe(OH)3,再向滤液中加入NH4F溶液,沉淀Ca2+为CaF2,滤渣III为CaF2,最后加入有机萃取剂萃取Zn2+,得到的水层主要为Ni2+,再向其中加入(NH4)2C2O4溶液,得到产品草酸镍晶体(NiC2O4·2H2O),高温煅烧无水NiC2O4的反应为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
用高能锂离子电池作电源电解含镍酸性废水回收Ni:高能锂离子中,Li为电源负极,FeS为电源正极,电解池中连接电源负极的为阴极,发生还原反应,连接电源正极为阳极,发生氧化反应,据此分析作答。
(1)NiC2O4·2H2O中镍元素+2价,氧元素2价,化合物中元素化合价总共为0,则碳元素+3价;将废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等能加快“酸浸”反应速率又能提高“酸浸”原料利用率,
故答案为:+3;废镍催化剂粉碎或适当加热、适当增大硫酸浓度、搅拌等;
(2)由上述分析可知,滤渣I为SiO2和CaSO4,
故答案为:SiO2和CaSO4;
(3)高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,气体为一氧化碳和二氧化碳,故反应为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑,
Ni2O3+3CO↑+CO2↑,
故答案为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑;
Ni2O3+3CO↑+CO2↑;
(4)①因该电解池的目的是从含镍酸性废水回收Ni,因此c池中发生还原反应,故Y电极为电源负极,X为电源正极,由电池总反应可知,其电源正极的反应材料为FeS;该电解池工作时,c池中Ni2+被还原,Cl-通过阴离子交换膜进入b中,a池中OH-发生氧化反应生成水和氧气,Na+通过阳离子交换膜进入b池中,因此b池中得到的主要物质为NaCl,
故答案为:FeS;NaCl;
②由①分析可知,其电解池总反应为:4OH-+2Ni2+![]() O2↑+2Ni+2H2O;由题可知,tmin内转移电子
O2↑+2Ni+2H2O;由题可知,tmin内转移电子![]() mol,Ni2+被还原为Ni,每生成1molNi,转移电子为2mol,因此可回收Ni的质量为
mol,Ni2+被还原为Ni,每生成1molNi,转移电子为2mol,因此可回收Ni的质量为![]() g,
g,
故答案为:4OH-+2Ni2+![]() O2↑+2Ni+2H2O;
O2↑+2Ni+2H2O;![]() 。
。