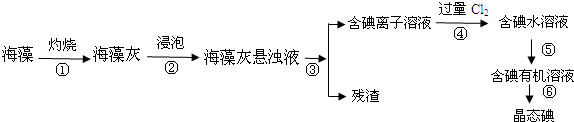
��Ŀ����
7���ߴ��辧������Ϣ��������Ҫ���ϣ���1�������ڱ������������п����ҵ����ƹ�İ뵼����ϵ���B������ĸ����
A������Ԫ������ B�������ͷǽ���Ԫ�صķֽ��߸���
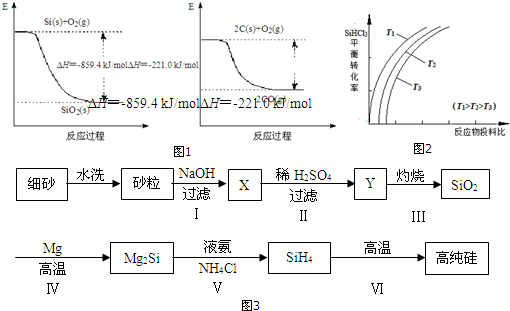
��2����ҵ����ʯӢ�ͽ�̿�����Ƶôֹ裮��֪����ͼ1����д����ʯӢ�ͽ�̿��ȡ�ֹ���Ȼ�ѧ����ʽSiO2��s��+2C��s��Si��s��+2CO��g����H=+638.4 kJ/mol��
��3��ijͬѧ������������Ʊ��ߴ��裨ͼ3����
��Y�Ļ�ѧʽΪH2SiO3��
��д����Ӧ������ӷ���ʽSiO2+2OH-=SiO32-+H2O��
��д����Ӧ���Ļ�ѧ����ʽSiO2+4Mg$\frac{\underline{\;����\;}}{\;}$Mg2Si+2MgO��
�ܲ�����й��飨SiH4���ֽ����ɸߴ��裬��֪����ֽ���¶�ԶԶ���ڹ��飬��ԭ�ӽṹ������ԭ�������ڱ��У����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��飮
��4�����ֹ�ת�������ȹ��飨SiHCl3������һ����ӦҲ�����Ƶôֹ裮�䷴Ӧ��SiHCl3 ��g��+H2��g��?Si��s��+3HCl��g������ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ����Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ2��ʾ������˵����ȷ����BC������ĸ����
A���÷�Ӧ�Ƿ��ȷ�Ӧ
B���������ʾ��Ͷ�ϱ�Ӧ����$\frac{n��{H}_{2}��}{n��SiHC{l}_{3}��}$
C���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
D��ʵ��������Ϊ���SiHCl3�������ʣ������ʵ�����ѹǿ��
���� ��1�������ͷǽ���Ԫ�صķֽ��߸�����Ԫ�ؾ���һ���Ľ�������ǽ����ԣ�
��2����ͼ1�ɵ��Ȼ�ѧ����ʽ����Si��s��+O2��g��=SiO2��s����H=-859.4 kJ/mol��
��2C��s��+O2��g��=2CO��g����H=-221.0 kJ/mol��
���ݸ�˹���ɣ���-�ٿɵ�Ŀ���Ȼ�ѧ����ʽ��
��3���٢�ɰ���ж����������������Ʒ�Ӧ����Na2SiO3�����˵õ�XΪNa2SiO3���ټ������ᡢ���˵õ�YΪH2SiO3��
����ͼ��֪��SiO2��Mg��Ӧ����Mg2Si������ԭ���غ��֪������MgO��
��Ԫ�طǽ�����Խǿ����Ӧ�⻯��Խ�ȶ���
��4��A����ͼ��֪��Ͷ�ϱ�һ��ʱ���¶�Խ�ߣ�SiHCl3��ת����Խ��˵�������¶�ƽ��������Ӧ�����ƶ���
B���¶�һ��ʱ��Ͷ�ϱ�Խ��SiHCl3��ת����Խ��˵��$\frac{n��{H}_{2}��}{n��SiHC{l}_{3}��}$��ֵԽ��
C�������¶�ƽ��������Ӧ������У�ƽ�ⳣ������
D������ӦΪ�������ʵ�������ķ�Ӧ������ѹǿ��ƽ�����淴Ӧ�����ƶ���
��� �⣺��1�������ͷǽ���Ԫ�صķֽ��߸�����Ԫ�ؾ���һ���Ľ�������ǽ����ԣ������ڸ��������ҵ����ƹ�İ뵼����ϣ���ѡ��B��
��2����ͼ1�ɵ��Ȼ�ѧ����ʽ����Si��s��+O2��g��=SiO2��s����H=-859.4 kJ/mol��
��2C��s��+O2��g��=2CO��g����H=-221.0 kJ/mol��
���ݸ�˹���ɣ���-�ٿɵ�Ŀ���Ȼ�ѧ����ʽΪ��SiO2��s��+2C��s��Si��s��+2CO��g����H=+638.4 kJ/mol��
�ʴ�Ϊ��SiO2��s��+2C��s��Si��s��+2CO��g����H=+638.4 kJ/mol��
��3����ɰ���ж����������������Ʒ�Ӧ����Na2SiO3�����˵õ�XΪNa2SiO3���ټ������ᡢ���˵õ�YΪH2SiO3���ʴ�Ϊ��H2SiO3��
�ڷ�Ӧ������ӷ���ʽΪ��SiO2+2OH-=SiO32-+H2O��
�ʴ�Ϊ��SiO2+2OH-=SiO32-+H2O��
����ͼ��֪��SiO2��Mg��Ӧ����Mg2Si������ԭ���غ��֪������MgO����Ӧ����ʽΪ��SiO2+4Mg$\frac{\underline{\;����\;}}{\;}$Mg2Si+2MgO��
�ʴ�Ϊ��SiO2+4Mg$\frac{\underline{\;����\;}}{\;}$Mg2Si+2MgO��
�����ڱ��У����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��飬
�ʴ�Ϊ�����ڱ��У����̼����ͬ���壬ԭ�Ӱ뾶Si����C����Ԫ�صķǽ���������̼Ԫ�أ���������ȶ������ڼ��飻
��4��A����ͼ��֪��Ͷ�ϱ�һ��ʱ���¶�Խ�ߣ�SiHCl3��ת����Խ��˵�������¶�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����A����
B���¶�һ��ʱ��Ͷ�ϱ�Խ��SiHCl3��ת����Խ��$\frac{n��{H}_{2}��}{n��SiHC{l}_{3}��}$��ֵԽ��SiHCl3��ת����Խ��˵��������Ϊ$\frac{n��{H}_{2}��}{n��SiHC{l}_{3}��}$����B��ȷ��
C�������¶�ƽ��������Ӧ������У�ƽ�ⳣ������C��ȷ��
D������ӦΪ�������ʵ�������ķ�Ӧ������ѹǿ��ƽ�����淴Ӧ�����ƶ���SiHCl3��ת���ʼ�С����D����
��ѡ��BC��
���� ��������Ϣ��������Ҫ����--��Ϊ���壬���������Ʊ��������̡��������ơ��Ȼ�ѧ����ʽ��д��Ԫ�����ڱ�Ӧ�á���ѧƽ��ͼ��Ӱ�����أ�����ƴ������Ŀ���Ѷ��еȣ�

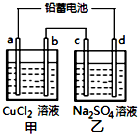 ��Ǧ���ص��ס��ҵ����е���Һ����֪Ǧ���ص��ܷ�ӦΪ��
��Ǧ���ص��ס��ҵ����е���Һ����֪Ǧ���ص��ܷ�ӦΪ��Pb��s��+PbO2��s��+2H2SO4��aq��$?_{�ŵ�}^{���}$2PbSO4��s��+2H2O��l��
���һ��ʱ�����c����d�������ֱ�μӷ�̪�Լ���c��������Һ��죬����˵����ȷ���ǣ�������
| A�� | d������ | |
| B�� | �ŵ�ʱǦ���ظ����ĵ缫��ӦʽΪ��PbO2��s��+4H+��aq��+SO42-��aq��+4e-�TPbSO4��s��+2H2O��l�� | |
| C�� | �����ü׳ؾ���ͭ��b��ӦΪ��ͭ | |
| D�� | ���ĸ��缫���Ͼ�Ϊʯī��������6.4gCuʱ�������й���������3.36L����״���£� |
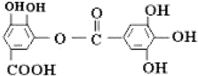
| A�� | �����£�����NaHCO3��Һ��Ӧ�ų�CO2 | |
| B�� | ���л���ķ���ʽΪC14H10O9 | |
| C�� | ��ϡH2SO4���ȣ�����2���л��� | |
| D�� | �ܷ�������ˮ�ⷴӦ��1mol���л�����ȫ��Ӧ���ĵ�8molNaOH |
| A�� | ú�� | B�� | ˮ | C�� | �ƾ� | D�� | �Ȼ�����Һ |
| A�� | H2��I2��HIƽ���������ѹ����ɫ���� | |
| B�� | ���죬����ơ��ƿ������ð��������ĭ | |
| C�� | �����У��ñ���̼������Һϴȥ����ư���ϵ����ۣ�������Һ��Ч������ | |
| D�� | �����Ƽҵ�У�������������ƷNH4Cl֮ǰ������Һ�м���NaCl������ͨ������NH3 |
 �±�ΪԪ�����ڱ��е������ڵIJ���Ԫ�أ������Ұ�ԭ�������������У�������Ҫ��ش����и�С�⣺
�±�ΪԪ�����ڱ��е������ڵIJ���Ԫ�أ������Ұ�ԭ�������������У�������Ҫ��ش����и�С�⣺| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
��2������Ԫ��ԭ�ӵ���Χ�����Ų����������ɽ�Ԫ�����ڱ��ֳ��������s����p����d����ds����f��������ʮ����Ԫ�طֱ�����s����d����ds����������s����Ԫ����2�֣�����d����Ԫ����8�֣�
��3���ԱȽϣ���һ������I1��Ga����I1��Ge�������������������=������
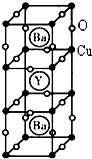
��4���Ʊ�ͭ����һ�����ͽ��ܸ��³����壬�侧���ṹ��ͼ��ʾ���о����֣��˸��³������е�CuԪ�������ּ�̬���ֱ�Ϊ+2�ۺ�+3�ۣ�YԪ�صĻ��ϼ�Ϊ+3�ۣ�BaԪ�صĻ��ϼ�Ϊ+2�ۣ�
�ٸ����ʵĻ�ѧʽΪ��YCu3Ba2O7��
�ڸ�������Cu2+��Cu3+��ԭ�Ӹ�����Ϊ��2��1��
| A�� | �ƾ���������ȼ��С���ʧ��Ӧ��Ѹ��ʹ��ʪĨ���˸ǣ��ơ��ص�ʧ��Ӧ����ĭ��������� | |
| B�� | ����ˮ���ռ�����ʱ���ȳ��ƾ��ƺ��Ƴ����� | |
| C�� | ��������������Һմ��Ƥ���ϣ�������ˮ��ϴ����Ϳ̼��������Һ | |
| D�� | �д���������й©ʱ��Ӧ�ý�����������Һ��ë����ס�ڱ���ߴ��� |
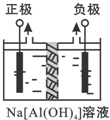 Al2O3��Al��OH��3������Ҫ����ԭ�ϣ�����Ҫ��ش����⣺
Al2O3��Al��OH��3������Ҫ����ԭ�ϣ�����Ҫ��ش����⣺