题目内容
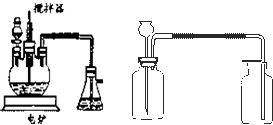
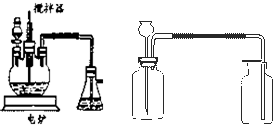
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫;三氧化硫经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。下面的装置是仿照工业上制备硫酸的流程设计出来的。

(1)写出二硫化亚铁与氧气反应的方程式:_______________________________________;
(2)图中甲、乙、丙、丁装置分别相当于工业生产制取硫酸中的_____________________;
(3)写出在催化剂表面所发生的反应的方程式:___________________________________;
(4)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,该如何控制与估计?
__________________________________________________________;
(5)学生为了探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而不用水,特用上述装置进行模拟实验。若丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直都没有任何现象,产生这种现象的原因是:_______________;处理尾气的方法有:__________________________________。
(1)4FeS2 + 11O2![]() 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
(2)甲、乙相当于接触室,丙、丁相当于吸收塔
(3)2SO2+ O2![]() 2SO3
2SO3
(4)可以通过调节气阀,控制气体流量,通过观察甲装置的冒泡速率估计
(5)原因有两个:①浓硫酸对三氧化硫的吸收效果远好于水,三氧化硫被浓硫酸完全吸收了;②插入浓硫酸溶液的导管插得太深,导致两个吸收瓶内的气压差较大,三氧化硫气体从水中冒出来了,与水蒸气化合形成酸雾 用碱液吸收

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.