题目内容
某温度下,反应NH4HS(s) NH3(g)+H2S(g)达平衡时,下列各情况中不能使平衡发生移动的是
NH3(g)+H2S(g)达平衡时,下列各情况中不能使平衡发生移动的是
[ ]
A.移走一部分NH4HS
B.其他条件不变时,通入SO2气体
C.容器容积不变,充入氮气
D.充入氮气,保持压强不变
答案:AC
解析:
解析:
|
导解:B选项SO2+2H2S=3S+2H2O,通入SO2气体会使H2S浓度减小,从而平衡右移;C,D选项是与反应无关的气体对化学平衡的影响. |

练习册系列答案
相关题目
关于下列各图的叙述不正确的是( )
| 化学方程式 | 平衡常数K |
| F2+H22HF | 6.5×1095 |
| Cl2+H22HCl | 2.6×1033 |
| Br2+H22HBr | 1.9×1019 |
| I2+H22HI | 8.7×102 |

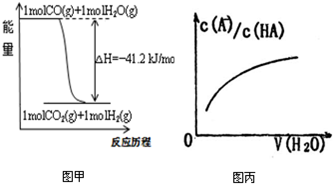
| A、已知CO的燃烧热283kJ/mol,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|

 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步. 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2