题目内容
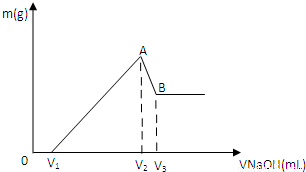
将0.1molMg、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:
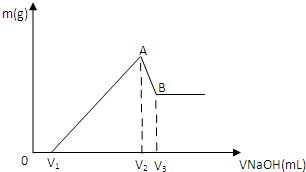
(1)写出A→B段反应的离子方程式
(2)A点沉淀的总物质的量n=
(3)欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH溶液的体积V2=
(4)若V1=60mL,则混合物中Mg的物质的量n(Mg)=
mL.

(1)写出A→B段反应的离子方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(2)A点沉淀的总物质的量n=
0.1mol
0.1mol
.(3)欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH溶液的体积V2=
300
300
mL.(4)若V1=60mL,则混合物中Mg的物质的量n(Mg)=
0.06mol
0.06mol
,V3点所加NaOH溶液的体积为V3=340
340
mL.
分析:(1)A→B段是氢氧化铝和氢氧化钠溶液发生的反应,据此写出离子方程式;
(2)A点时沉淀量最大,说明镁、铝全部生成沉淀,根据原子守恒计算沉淀的物质的量;
(3)欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,根据盐酸的量计算氢氧化钠的体积;
(4)若V1=60mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,根据金属和盐酸之间的关系计算镁的质量,B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒计算氢氧化钠的体积.
(2)A点时沉淀量最大,说明镁、铝全部生成沉淀,根据原子守恒计算沉淀的物质的量;
(3)欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,根据盐酸的量计算氢氧化钠的体积;
(4)若V1=60mL,说明盐酸有剩余,根据氢氧化钠的量计算剩余盐酸的量,从而得出和金属反应的盐酸的量,根据金属和盐酸之间的关系计算镁的质量,B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒计算氢氧化钠的体积.
解答:解:(1)A→B段是氢氧化铝和氢氧化钠溶液发生的反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A点时沉淀量最大,说明镁、铝全部生成沉淀Mg(OH)2、Al(OH)3,根据原子守恒知A点沉淀的总物质的量等于镁铝的物质的量,为0.1mol,故答案为:0.1mol;
(3)欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,则盐酸的物质的量等于氢氧化钠的物质的量=3mol/L×0.1L=0.3mol,氢氧化钠的体积=
=300mL,
故答案为:300;
(4)若V1=60mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.06L=0.06mol,则和金属反应的盐酸的物质的量=3mol/L×0.1L-0.06mol=0.24mol,
设镁的物质的量是x,铝的物质的量是y,
解得
,
所以镁的物质的量是0.06mol,
B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.3mol=0.34mol,所以氢氧化钠的体积=
=340mL,
故答案为:0.06mol;340.
(2)A点时沉淀量最大,说明镁、铝全部生成沉淀Mg(OH)2、Al(OH)3,根据原子守恒知A点沉淀的总物质的量等于镁铝的物质的量,为0.1mol,故答案为:0.1mol;
(3)欲使Mg2+、Al3+刚好沉淀完全时,溶液中的溶质是氯化钠,则盐酸的物质的量等于氢氧化钠的物质的量=3mol/L×0.1L=0.3mol,氢氧化钠的体积=
| 0.3mol |
| 1mol/L |
故答案为:300;
(4)若V1=60mL,说明盐酸有剩余,剩余盐酸的物质的量=1mol/L×0.06L=0.06mol,则和金属反应的盐酸的物质的量=3mol/L×0.1L-0.06mol=0.24mol,
设镁的物质的量是x,铝的物质的量是y,
|
解得
|
所以镁的物质的量是0.06mol,
B点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.3mol=0.34mol,所以氢氧化钠的体积=
| 0.34mol |
| 1mol/L |
故答案为:0.06mol;340.
点评:本题考查镁、铝的性质及图象分析,明确曲线变化方式的反应及拐点时溶液中的溶质是解本题关键,注意结合原子守恒来解答,难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目