题目内容
可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
B
解析试题分析:A.达平衡后,加入催化剂化学平衡不发生移动。则C%不变。错误。B. 在温度不变的情况下,增大压强,C的含量升高。根据化学平衡移动原理。增大压强,化学平衡向气体体积减小的方向移动。即正反应方向是气体体积减小的反应。所以n>e+f.正确。C.在压强不变的情况下,升高温度C的含量降低。平衡向逆反应方向移动。由于升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应,则正反应是个放热反应。错误。D由于A是固体,当反应达到化学平衡后增加A的量平衡不会发生移动。错误。
考点:考查外界条件如温度、压强、催化剂、物质的量等对化学平衡的影响的知识。

下图表示反应A(g)+B(g) nC(g) △H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是
nC(g) △H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是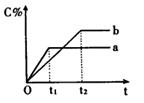
| A.反应由逆反应开始 |
| B.a表示有催化剂,b表示无催化剂 |
| C.若n=2,其它条件相同,a比b的压强大 |
| D.若其它条件相同,a比b的温度高 |
某密闭容器中发生如下反应:2X(g)+Y(g)  Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是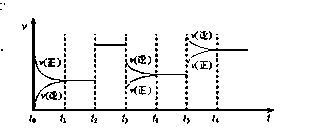
| A.t3时减小了压强 |
| B.t5时增大了压强 |
| C.t6时刻后反应物的转化率最高 |
| D.t1 - t2时该反应的平衡常数大于t6 时反应的平衡常数 |
恒容容器中反应:A(g)+3B(g)  2C(g)+3D(g),达到平衡的标志是
2C(g)+3D(g),达到平衡的标志是
①体系的压强不再改变 ②混合气体的平均相对分子质量不再改变 ③各组分的浓度不再改变 ④混合气体的密度不变 ⑤反应速率vA: vB: vC: vD=1:3:2:3 ⑥单位时间内1 mol A断键反应,同时2 mol C也断键反应
| A.②③⑤⑥ | B.②③④⑤ | C.①④⑤⑥ | D.①②③⑥ |
2012年是勒夏特列诞生192周年,下列叙述中,不用平衡移动原理解释的是 ( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
工业生产苯乙烯是利用乙苯的脱氢反应:
下列说法错误的是
| A.该反应中生成物的总能量高于反应物 |
| B.增大压强反应物活化分子百分数不变 |
| C.升高温度可以提高原料乙苯的转化率 |
| D.不断分离出苯乙烯可加快反应速率 |
COCl2(g)  CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
CO(g) + Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2 分解率的是
| A.①④⑥ | B.①②④ | C.②③⑥ | D.③⑤⑥ |
在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.化学计量数关系:a>b |
 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加