题目内容
合理地固定和利用CO2能有效减少空气中的温室气体,产物还能造福人类.(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为______.
(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=______.
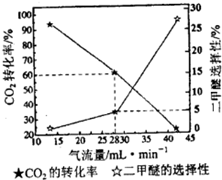
②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为______.

③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正______v逆(填“>”、“<”或“等于”)
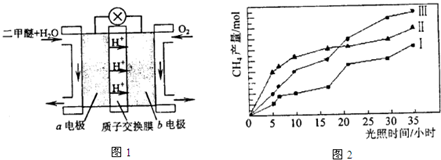
④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为______.
(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为______.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为______.

【答案】分析:(1)根据题目信息可知H2S和CO2生成C6H10O5)n和S,根据原子守恒来配平;
(2)①根据根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式,反应热也乘
以相应的系数进行相应的运算;
②先根据二甲醚的选择性求出理论上生成的二甲醚,然后根据物质的量之比等于化学计量数之比求出反应的CO2的物质的量,最后根据CO2的转化率求出实际通入的CO2;
③计算浓度商,与平衡常数比较,可判断反应已经平衡,故v正=v逆;
④反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子.
(3)据题目信息分析可循环利用的物质;
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.
解答:解:(1)H2S和CO2生成C6H10O5)n和S,化学方程式为:12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O,
故答案为:12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1 ①
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1 ②
由盖斯定律可知,通过①×2+②可得
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),则△H=-49.0kJ/mol×2-23.5kJ/mol=-121.5kJ/mol,
故答案为:-121.5kJ/mol;
②生产0.3mol二甲醚,理论上应生成二甲醚% =6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为
=6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为 =20mol,
=20mol,
故答案为:20mol;
③t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,c(H2O)=0.6mol?L -1,浓度熵Q= =400=K,所以反应已经平衡,故v正=v逆;
=400=K,所以反应已经平衡,故v正=v逆;
故答案为:=;
④反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+.
(3)在所得溶液中加氧化钙,氧化钙与水反应生成氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠又是捕捉室中的反应物,所以可以循环利用;碳酸钙高温生成氧化钙和二氧化碳,由题意可得氧化钙还可循环利用,因此氧化钙和氢氧化钠都可以循环利用;
故答案为:氧化钙和氢氧化钠;
(4)由图2可知,在0~0h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
故答案为:v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
点评:本题是道综合题,涉及到的知识点较多,考查了学生灵活运用知识、分析问题和解决问题的能力,难度较大.
(2)①根据根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式,反应热也乘
以相应的系数进行相应的运算;
②先根据二甲醚的选择性求出理论上生成的二甲醚,然后根据物质的量之比等于化学计量数之比求出反应的CO2的物质的量,最后根据CO2的转化率求出实际通入的CO2;
③计算浓度商,与平衡常数比较,可判断反应已经平衡,故v正=v逆;
④反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子.
(3)据题目信息分析可循环利用的物质;
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.
解答:解:(1)H2S和CO2生成C6H10O5)n和S,化学方程式为:12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O,
故答案为:12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1 ①
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1 ②
由盖斯定律可知,通过①×2+②可得
2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),则△H=-49.0kJ/mol×2-23.5kJ/mol=-121.5kJ/mol,
故答案为:-121.5kJ/mol;
②生产0.3mol二甲醚,理论上应生成二甲醚%
 =6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为
=6mol,反应的反应的CO2的物质的量为12mol,实际通入的CO2的物质的量为 =20mol,
=20mol,故答案为:20mol;
③t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,c(H2O)=0.6mol?L -1,浓度熵Q=
 =400=K,所以反应已经平衡,故v正=v逆;
=400=K,所以反应已经平衡,故v正=v逆;故答案为:=;
④反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:CH3OCH3+3H2O-12e-=2CO2+12H+.
(3)在所得溶液中加氧化钙,氧化钙与水反应生成氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠又是捕捉室中的反应物,所以可以循环利用;碳酸钙高温生成氧化钙和二氧化碳,由题意可得氧化钙还可循环利用,因此氧化钙和氢氧化钠都可以循环利用;
故答案为:氧化钙和氢氧化钠;
(4)由图2可知,在0~0h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
故答案为:v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
点评:本题是道综合题,涉及到的知识点较多,考查了学生灵活运用知识、分析问题和解决问题的能力,难度较大.

练习册系列答案
相关题目

 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”. 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ